IMbrave050 是一项开放标签的随机对照研究,评估的是阿替利珠单抗联合贝伐珠单抗(T+A 方案)作为肝癌术后辅助治疗的疗效和安全性。在今年的 AACR 会议上该研究公布了期中分析的结果。
研究入组的是接受了手术切除或射频消融的肝细胞癌患者,这些患者存在肿瘤复发的高危因素。对于手术切除患者,高危因素包括:肿瘤直径>5cm、肿瘤数目超过 3 枚、血管侵犯(包括微血管侵犯或 Vp1-2 型的肉眼癌栓)、肿瘤差分化;对于消融患者,高危因素包括:肿瘤单发者,直径 2-5cm,或肿瘤肿瘤数目不超过 4 枚,多肿瘤直径不超过 5cm。入组患者按照 1:1 的比例随机接受 T+A 方案辅助治疗,最长 1 年或 17 个周期,或主动监测。在国内,TACE 是高危复发患者术后标准治疗的方式之一,因此允许患者在术后接受一次辅助 TACE 治疗,再随机分组,最终有 10% 的患者接受过 TACE 治疗。主动监测组的患者在复发之后可以交叉到治疗组,接受免费的 T+A 治疗。
研究一共入组了 668 例患者。在中位随访 17.4 月后,主要终点方面,与主动监测相比,T+A 方案辅助治疗显著改善中心影像评估的无复发生存期(RFS)(两组的中位 RFS 均没有达到,HR=0.72,95%CI 0.56-0.93,P=0.012)。P 值低于预设的阳性界值 0.0195,该研究达到了主要研究终点。 两组的 1 年 RFS 率分别为 78% 和 65%;1 年复发率则分别为 20% 和 34%(HR=0.67,95%CI 0.52-0.88,P=0.003)。
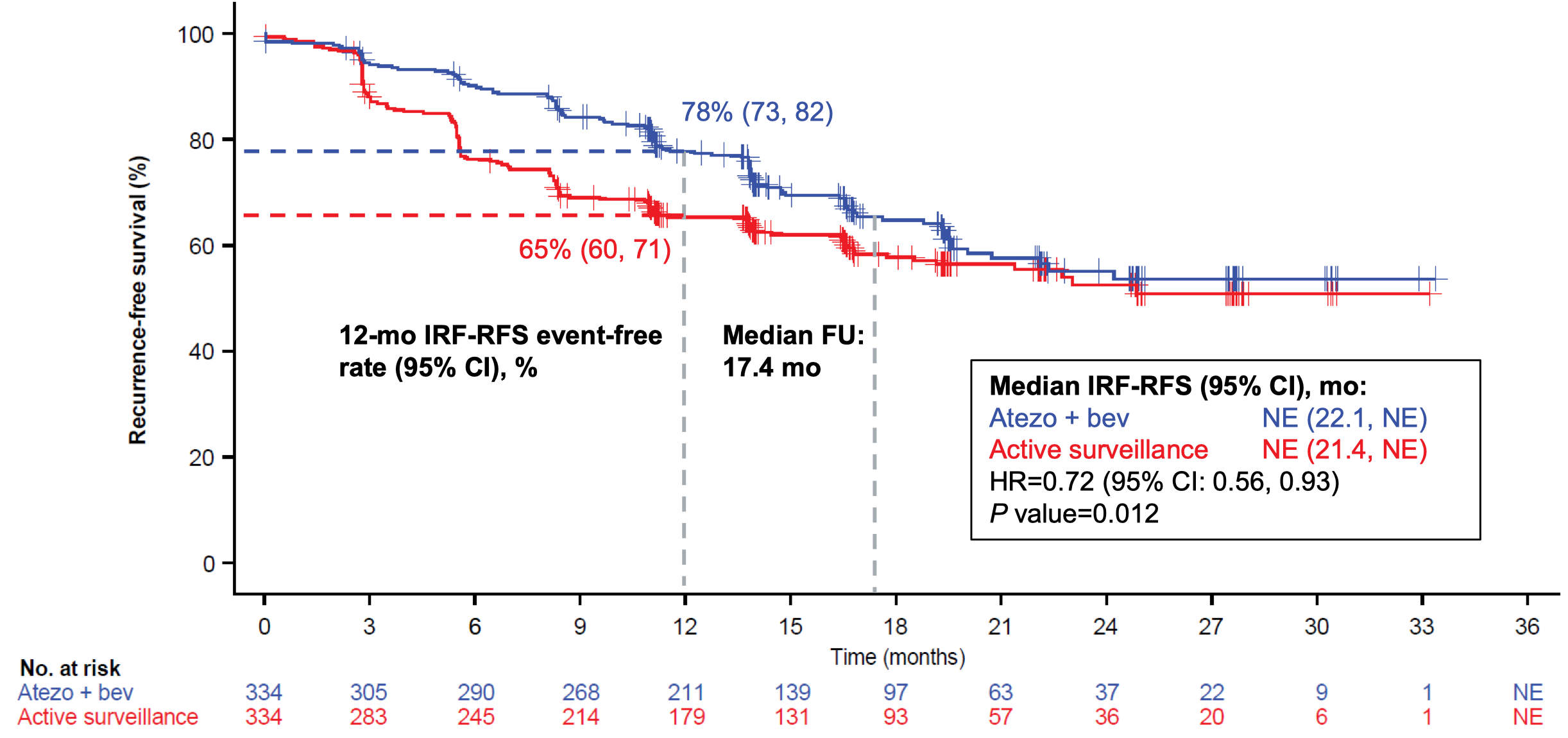
从 RFS 生存曲线上看,在 18 月以后,两组的 RFS 曲线有合并的趋势来看。因此,T+A 改善 RFS 是因为减少复发还是推迟复发,目前还不确定。 18 月之后,删失的患者数目较多,patients at risk 的患者数目较少(每组少于 100 例),会导致结果的不稳定,还需要进一步跟踪最终的分析结果。我推测,如果是免疫治疗引起的 RFS 改善,应该是减少复发;如果是靶向治疗引起的 RFS 改善,应该是推迟复发。
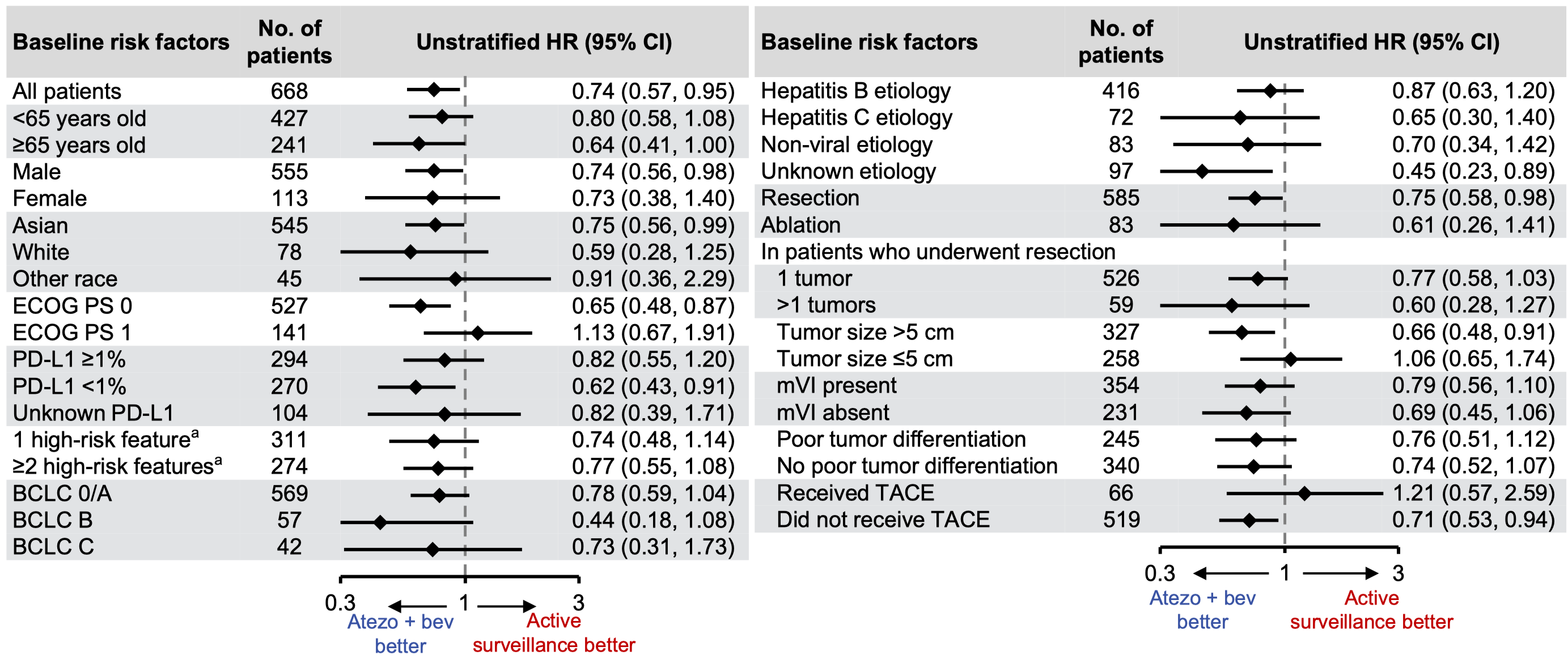
亚组分析的结果显示,多数亚组的患者接受 T+A 治疗可以改善 RFS,少数获益不确切的亚组包括肿瘤直径小于 5cm 或接受过 TACE 治疗,后者应该是入组患者较少导致的疗效数据不稳定。
目前有 7% 的患者死亡,因此 OS 的数据远没有成熟。但从现有的数据看,两组的 OS 曲线纠缠在一起,还看不到改善的趋势。 研究者解释,用药组有 3 例患者死于新冠相关死亡,而对照组没有。但值得欣慰的是,不管是用药组还是主动监测组,OS 的数据还不错,2 年生存率达到了 90% 左右,3 年生存率也在 80% 的水平。从目前的数据看,随访到相对成熟的 OS 数据,可能至少需要再等待两年。
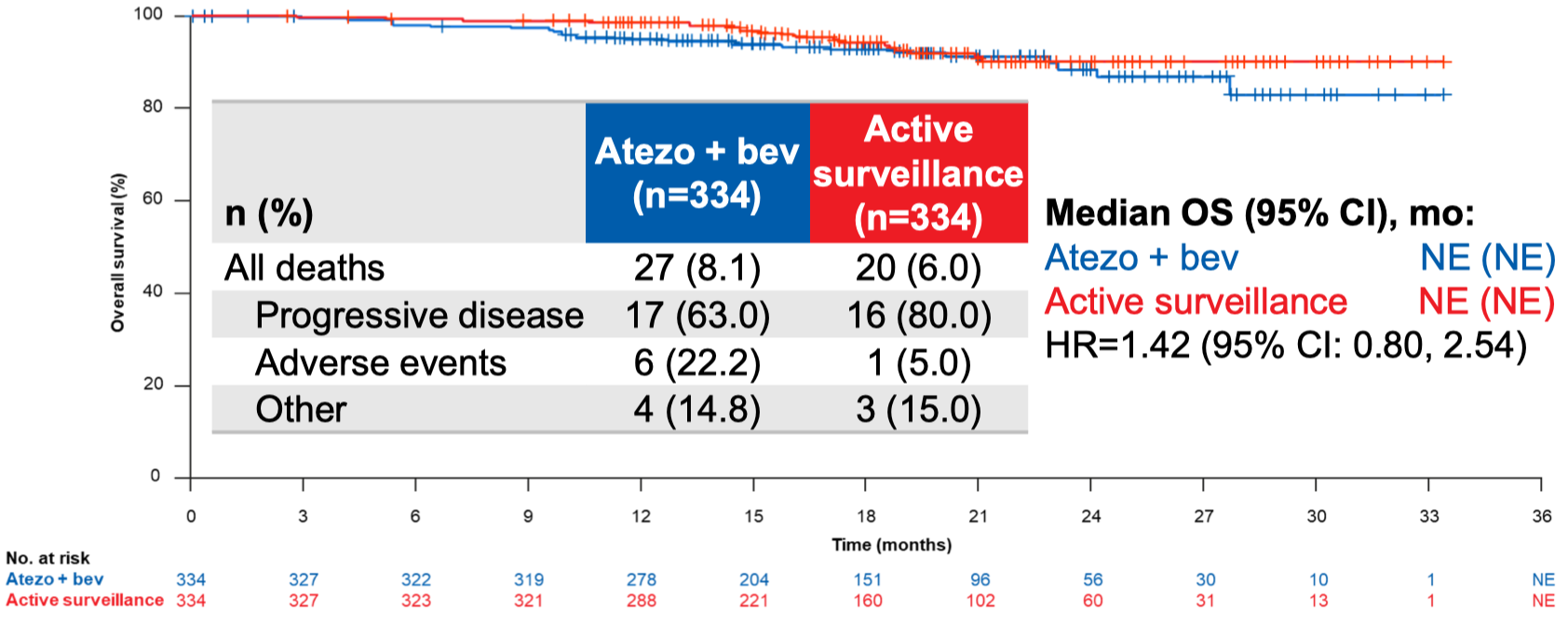
导致 OS 曲线难以分开有两方面的原因:(1)肝癌跟别的瘤种有些差别,肝癌复发之后,还有很大比例的患者有再次手术等根治性治疗的机会,因此复发之后的生存还会有很长。(2)主动监测组的患者在复发之后允许交叉到 T+A 组,而目前有 61% 的患者完成了交叉,这会在很大程度上稀释 OS 方面的获益,因为 T+A 方案是晚期肝癌患者目前的优选一线治疗方案,在疗效和副作用方面达到了不错的平衡。
治疗安全性方面没什么特殊的,3-4 级治疗相关不良事件的发生率 34.9%,跟 IMbrave150 研究基本一致。
长久以来,肝癌术后缺少公认的有效的辅助治疗,欧美的指南不推荐任何辅助治疗,中国的指南则推荐术后辅助 TACE。虽然在肝癌领域 RFS 还没有被证实可以作为 OS 替代终点,但因为以往肝癌辅助治疗领域几乎是一片空白,即使是 RFS 的改善,也是历史性的突破。T+A 方案应该会获批肝细胞癌辅助治疗的适应证,并被国际指南推荐,但因为目前还没有看到改善 OS 的趋势,该方案还不会成为术后辅助治疗的标准方案。 在临床用药中,也需要跟患者充分讨论,告知患者治疗的有效性(改善 RFS)和局限性(是否延长 OS 还不确定),让患者选择在手术后开始用药以推迟复发,还是等待肿瘤复发了再做积极治疗。
另一个需要值得密切关注的问题是单独使用免疫治疗能否达到相似的效果? 目前多项 PD-1/PD-L1 单抗单药用于肝癌术后辅助治疗的临床试验正在开展(例如 KEYNOTE-937、JPITER-04),但结果都还没有揭晓。预期在今年内这些研究会纷纷公布结果,期待看到免疫单药辅助治疗的疗效。此外,正在开展的 EMERALD-2 研究分成了 3 个队列,分别是:PD-L1 抗体(度伐利尤单抗)+贝伐珠单抗,度伐利尤单抗+安慰剂,和安慰剂对照。该研究的结果也非常值得期待,除了该研究采用的是安慰剂对照的盲性设计,对研究提出了更高的要求;设计上有了免疫单药组,也可以帮助疗效析因,回答在免疫治疗的基础上增加贝伐珠单抗是否可以进一步改善 RFS。
