肝细胞癌
NRG/RTOG 1112:立体定向放疗(SBRT)联合索拉非尼 vs 索拉非尼用于晚期肝癌一线治疗( #489 )
在三四年前,对晚期肝癌有确切疗效的药物只有索拉非尼,但疗效不够满意。尝试在索拉非尼基础上联用别的药物治疗,效果往往不好。这样一个临床试验入组的是局部晚期的肝癌患者,肿瘤的总直径不超过 20 cm,肿瘤数目不超过 5,肝外转移的数目不超过 3 枚。这些患者随机接受 SBRT 联合索拉非尼或索拉非尼单独使用。SBRT 组的患者接受 27.5-50 Gy 总剂量的放疗(5 次分割),随后接受索拉非尼半量用药,4 周后再调整为完整剂量;对照组则直接接受完整剂量的索拉非尼治疗。
研究在进行过程中,肝癌的标准一线治疗发生了改变(阿替利珠单抗+贝伐珠单抗 [T+A] 方案成为了一线优选治疗),因此研究提前结束了入组。共有 177 例患者接受了随机分组,其中 3/4 左右合并大血管癌栓。主要终点方面,SBRT 的联合显著改善了总生存期(OS),中位 OS 分别为 15.8 月和 12.3 月(HR=0.77,90%CI 0.59-1.01,单侧 P=0.055)。无进展生存期(PFS)亦得到改善,中位 PFS 分别为 9.2 月和 5.5 月(HR=0.55,95%CI 0.40-0.75,P=0.0001)。因为 SBRT 组的索拉非尼剂量减低,降低了药物毒性,并且 SBRT 推迟肿瘤进展,索拉非尼组的药物暴露时间 5.1 月,索拉非尼单药组只有 2.7 月。
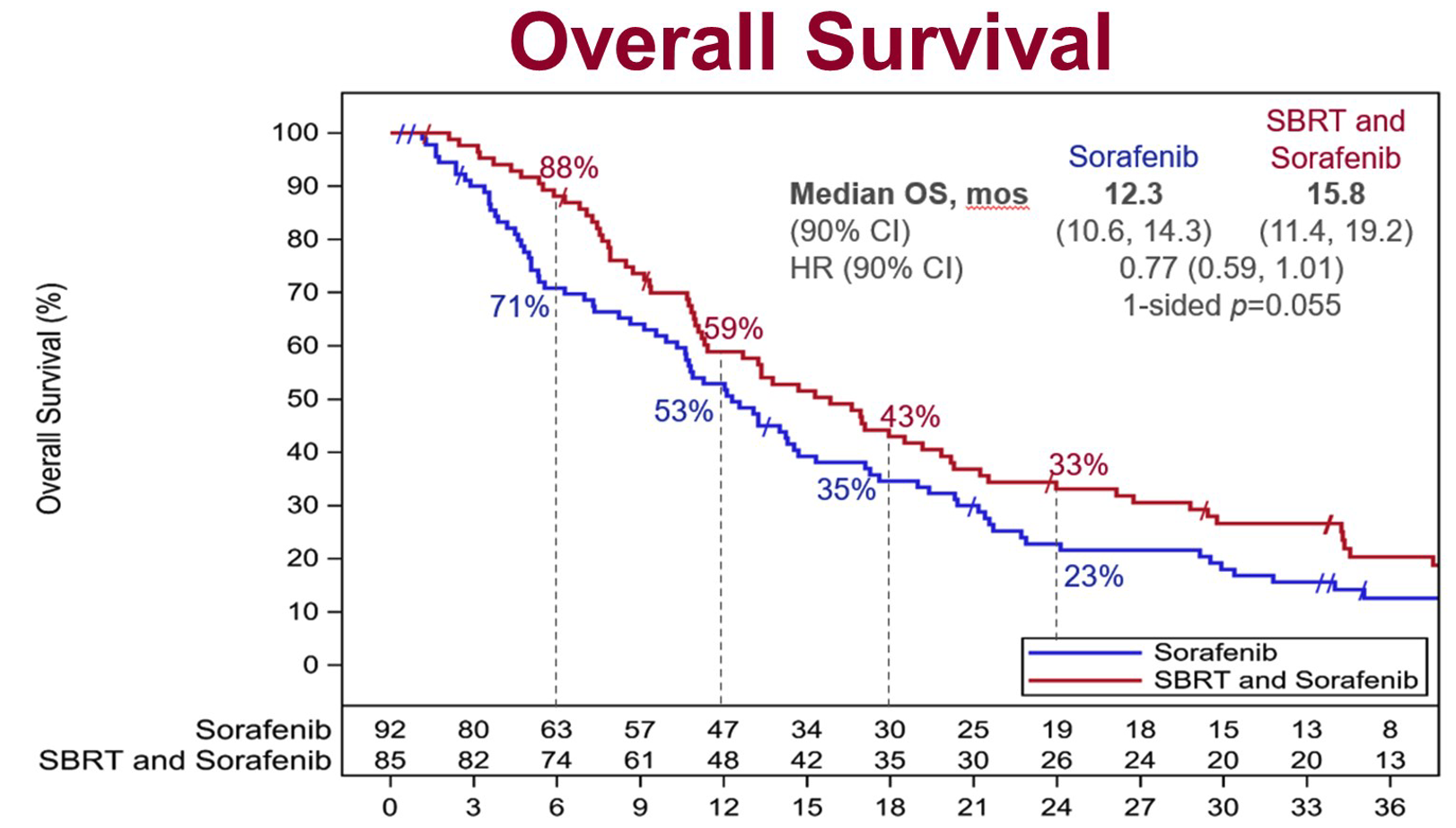
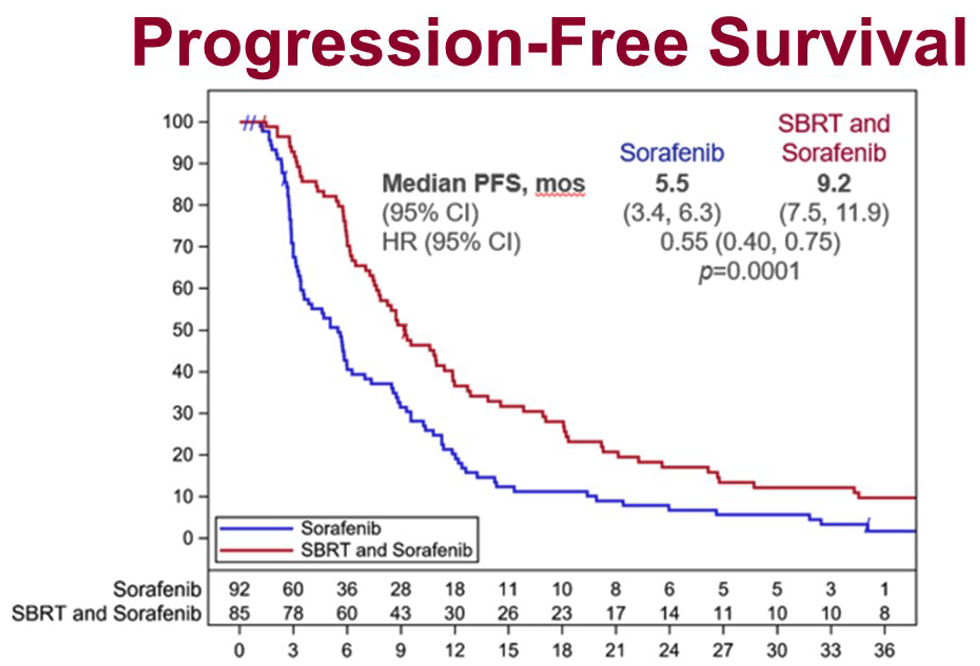
这项研究提示,对于局部晚期的肝癌患者,SBRT 是跟索拉非尼有益的联合,特别适用于合并大血管癌栓的患者。
肝癌合并门静脉癌栓术后辅助治疗:TACE 联合索拉非尼 vs 索拉非尼( #493 )
合并门静脉癌栓是晚期肝癌的标志,尽管部分患者仍然可以接受手术切除,但是手术后复发率很高,长期预后不佳。中山大学附属第一医院匡铭教授牵头的这项随机对照研究,将接受了手术切除的伴有门静脉癌栓的患者随机分组,分为 TACE 联合索拉非尼治疗或者索拉非尼单独应用。
TACE 在随机分组后第二天进行,索拉非尼在随机分组后第 3 天开始用药,剂量是标准的 400 mg bid。2019 年 10 月至 2022 年 3 月之间,158 例患者入组本研究。中位随访了 28.4 月后,TACE 联合索拉非尼组的无复发生存期(RFS)显著优于索拉非尼组(16.8 vs. 12.6 月,HR=0.57,P=0.002),OS 也更优(30.4 vs. 22.5 月,HR=0.57,P=0.017)。不良反应方面,在索拉非尼基础上增加 TACE 治疗未明显增加毒性反应。
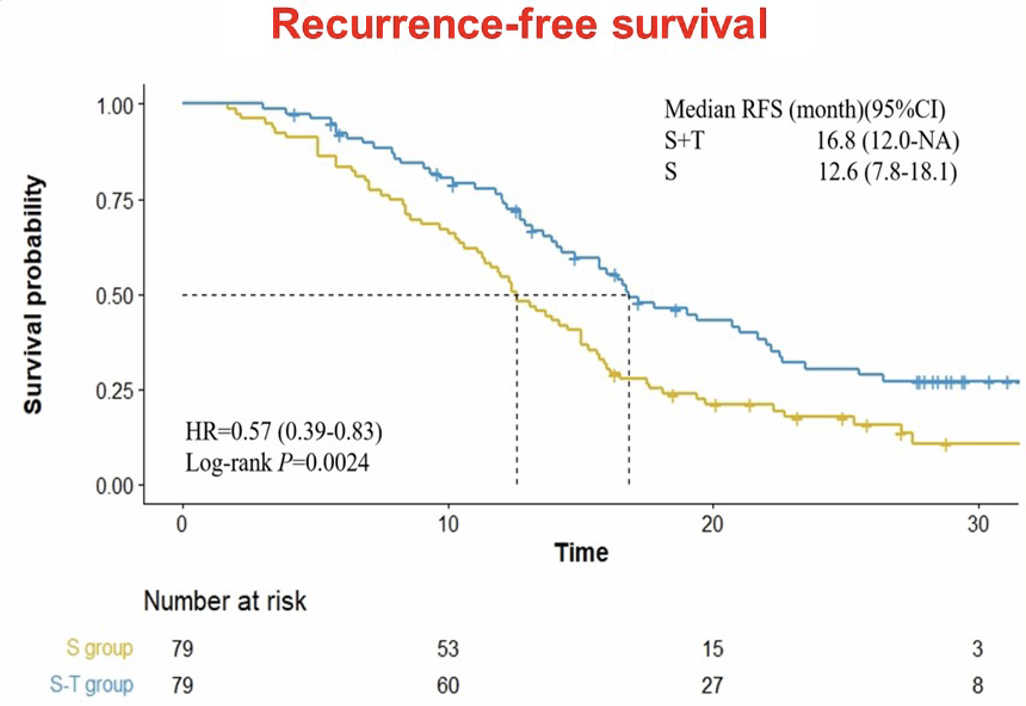
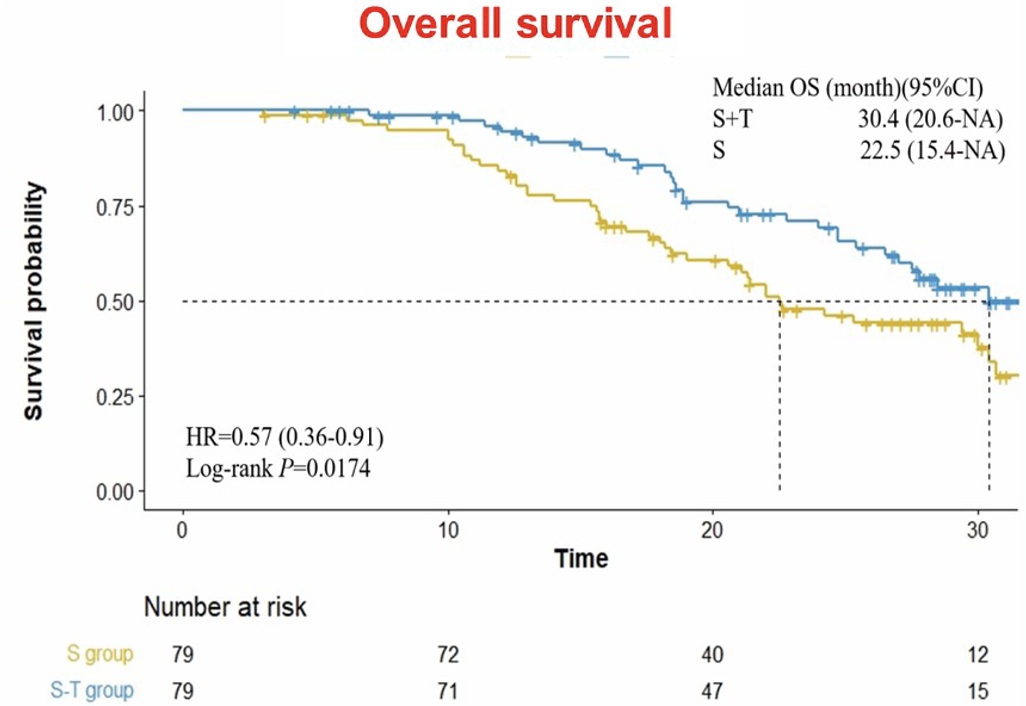
因为直接手术切除疗效不佳,合并门静脉癌栓的肝癌患者目前手术切除越来越少。但仍有一些患者执意行手术切除,对于这些复发风险极高的患者,TACE 联合索拉非尼作为辅助治疗值得选择。
原发性或转移性肝癌患者使用放疗缓解疼痛的 3 期对照研究( #LBA492 )
肝内肿瘤负荷巨大的原发性或转移性肝癌患者往往伴随癌痛,使用镇痛药物往往疗效不佳,很大程度上影响患者生活质量。全肝放疗理论上可能可以快速缓解癌痛。研究一共入组了 66 例患者,包括 43 例转移性肝癌,23 例 HCC 患者。这些患者随机接受 1 个分割的 8 Gy 剂量的放疗或接受最佳支持治疗。42 例患者完成了基线和 1 月后的疼痛评分。
结果方面,1 月后的疼痛改善在治疗组和对照组的比例分别为 67% 和 22%(P=0.004),而更长期的随访显示,治疗组的患者的长期生存似乎也优于对照组,3 月生存率分别为 51% 和 33%。可惜疼痛评分相对主观,而且这是一个非盲性设计的研究,如果能用客观指标来评价疼痛改善可能更有说服力,例如对比治疗前后的镇痛药用量的变化等等。
RATIONALE-301:替雷利珠单抗 vs 索拉非尼用于晚期肝癌一线治疗的生活质量对比( #495 )
在 2022 年 ESMO 上,这项研究公布了主要研究结果,替雷利珠单抗这项 PD-1 抗体用于晚期肝癌的一线治疗,患者 OS 不劣于索拉非尼,达成了非劣效的研究终点。患者报告的结局也是这项研究的一个关键的次要终点,可以预期 PD-1 抗体的治疗耐受性一般比索拉非尼会好不少。
结果方面,在治疗后 4 周和 6 周,替雷利珠单抗组的 QLQ-C30 总体生活质量评分维持得更好,患者机体功能维持更好,患者疲倦度没有差别;QLQ-HCC18 总体评分也维持得更好,但疼痛在两组之间无差异。至生活质量恶化方面,QLQ-C30 总体生活质量替雷利珠单抗优于索拉非尼(HR=0.68,95%CI 0.49-0.94),QLQ-HCC18 总体生活质量也优于索拉非尼(HR=0.53,95%CI 0.34-0.81)。
[[CheckMate 459]] 研究也显示了相似的结果,现在在替雷利珠单抗上又重复了出来。尽管使用 PD-1 抗体单药治疗的患者非常少,但如果在索拉非尼和 PD-1 抗体之间只能选择一个,那毫无疑问,PD-1 抗体是更好的选择。
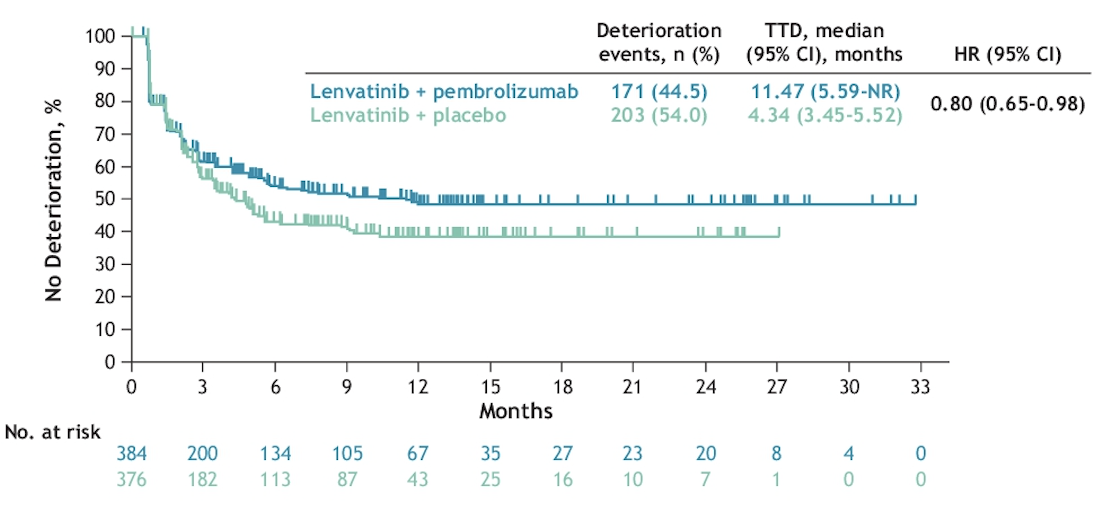
LEAP-002:仑伐替尼+帕博利珠单抗 vs 仑伐替尼+安慰剂用于晚期肝癌一线治疗的生活质量对比( #506 )
在 2022 年 ESMO 上,LEAP-002 公布了其主要结果。与仑伐替尼单药相比,增加帕博利珠单抗未能在统计学上显著改善患者的 OS 和 PFS,该研究未达到主要研究终点。一般而言,与安慰剂相比,PD-1 抗体对患者生活质量的影响比较小,而这又是一个盲性设计的临床试验,因此生活质量的评估会较为客观。
整体而言,两组的生活质量的各种衡量都没有差异,这也印证了上述观点。QLQ-C30 评估的总体的生活质量下降方面,联合治疗组显示出了改善的取势,至生活质量下降时间分别为 11.47 月和 4.34 月(HR=0.80,95%CI 0.65-0.98)。这应该是纯粹是肿瘤学效果引发的联合治疗组生活质量维持更好。
REFINE:瑞戈非尼真实世界研究中药物的起始剂量与长期疗效的关系( #518 )
这项研究包含了 1005 例在临床实践中使用瑞戈非尼的患者。因为瑞戈非尼的治疗毒性相对较大,多数患者难以耐受,我们临床上往往从小剂量开始,每日 1 次,每次 2 粒(完整剂量是每日 1 次,每次 4 粒),根据患者的耐受情况,慢慢增加剂量。那这种降低的起始剂量会不会影响药物的疗效目前并不清楚。
在这项真实世界研究中,更多的亚洲患者使用完整剂量,肝功能较好的患者也更多地使用完整剂量。PFS 在各个起始剂量之间无差异,但是起始剂量比较低的患者 OS 更短,并且呈剂量依赖的关系。
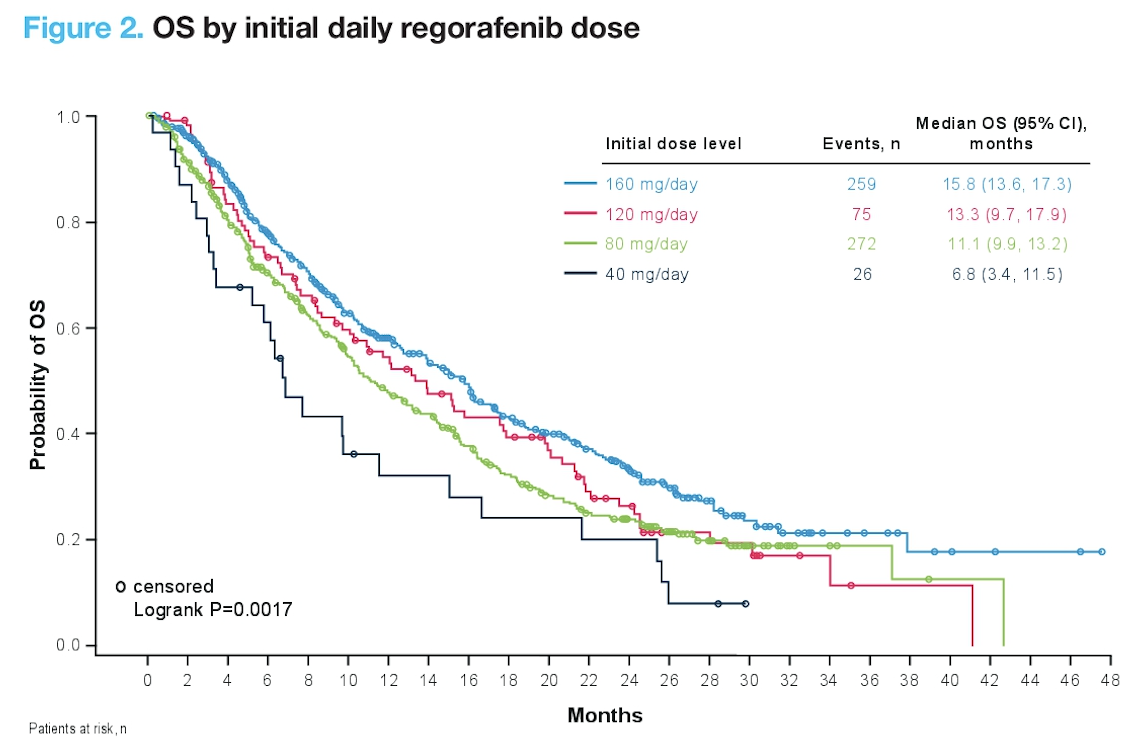
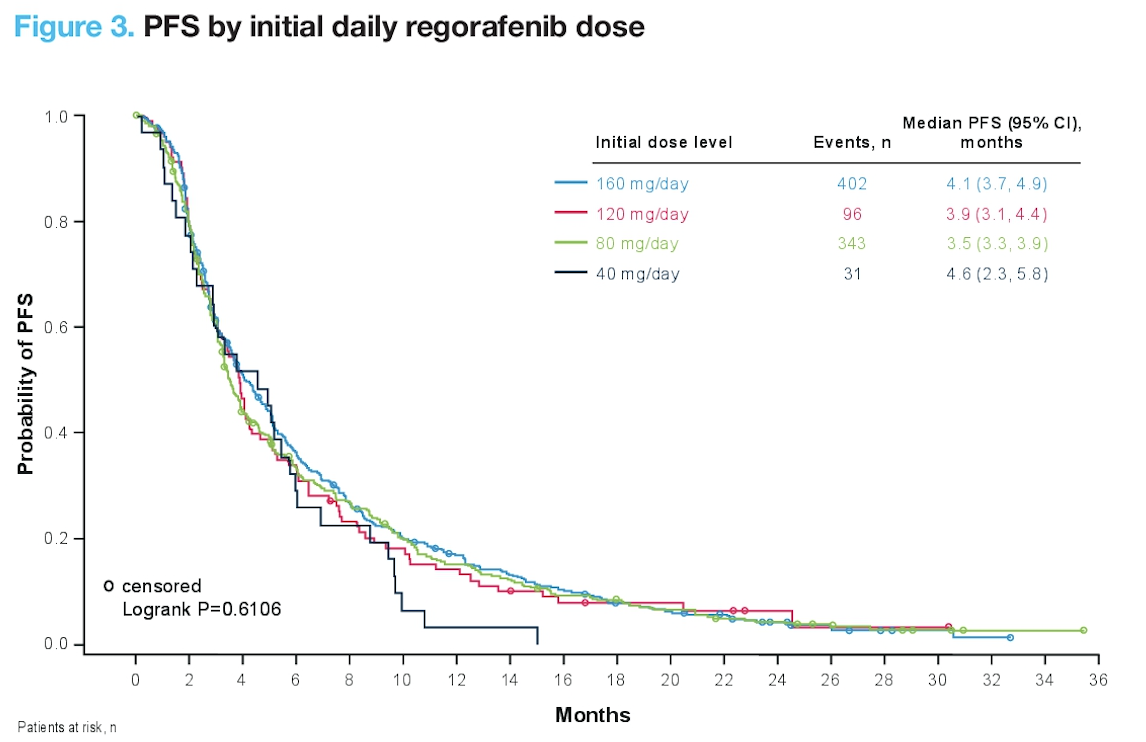
那是不是起始剂量减低导致 OS 较差呢?这需要谨慎地看这样的结果,因为低起始剂量的患者往往肝功能比较差;使用完整剂量的亚洲患者较多,而亚洲的肝癌管理方式跟欧美存在差异。因此并不一定是药物剂量用得低了,患者的治疗效果就差了。
纳武利尤单抗联合伊匹木单抗(O+Y)用于肝癌患者后线治疗的回顾性研究( #554 )
这是一项多中心的观察性研究,评估 O+Y 双免疫治疗用于肝癌的后线治疗的疗效。在接受过免疫治疗的 35 例患者中,观察到了 7 例部分缓解,ORR 为 20%;在未接受过免疫治疗的患者中,ORR 为 41.7%。但没有效果的病人进展很快,用过免疫治疗的患者,PD 率为 62.9%,中位 PFS 不到 2 月。这项回顾性研究和香港大学的一项前瞻性研究都提示,前线用过 PD-1 或 PD-L1 抗体治疗进展的患者,后线联用 CTLA-4 抗体仍然会有部分患者会有效。
以下是一些新药:
Tebotelimab(PD-1/LAG-3 双特异性抗体)用于晚期肝癌的后线治疗的 1/2 期临床试验( #578 )
Tebotelimab 是国内再鼎公司开发的一个靶向 PD-1 和 LAG-3 双特异性抗体。这项多中心的 1-2 期临床试验入组的是经治的肝癌患者,分为剂量递增阶段和剂量扩展阶段,扩展阶段分别入组了 30 例免疫治疗经治患者和 30 例免疫治疗非经治患者。主要研究者是我们中心的任正刚教授。整体而言,治疗的安全性不错,剂量扩展阶段 G3 及以上治疗相关 AE 的发生率 19%,跟一般的 PD-1 抗体差不多。疗效方面,免疫治疗经治患者的 ORR 3%,免疫治疗非经治患者的 ORR 13.3%。看起来这个药物增加了对 LAG-3 这个靶点的拮抗还是有一些疗效的,但与 PD-1 抗体相比,可能优势微弱。
Cobolimab(TIM-3 抗体)联合 dostarlimab(PD-1 抗体)用于晚期肝癌一线治疗的 2 期研究( #580 )
这项 2 期研究计划入组 40 例患者,目前入组了 21 例,其中 15 例患者接受过至少一次治疗后影像评估。6 例病人出现了缓解,ORR 40%。初步的安全性数据看起来治疗耐受性不错,只有 1 例 G4 治疗相关 AE(TRAE)。期待 TIM-3 这个靶点在肝癌领域更多的探索。如果这么高的 ORR 率可以在扩大的样本量中验证出来的话,算是一件很好的事情。
Bavituximab(磷脂酰肌肽抗体)联合帕博利珠单抗用于晚期肝癌一线治疗的 2 期研究( #584 )
这项研究入组的是未经治的肝癌患者,目前已经完成了 28 例患者的入组。安全性方面,除了腹泻,其他似乎都是跟帕博利珠单抗关系更大。疗效方面,ORR 32.1%。这个研究同时开发了一个免疫微环境的诊断标志物,有 19 例患者接受了标志物监测,阳性的 8 例患者中 5 例出现了缓解;而阴性的 11 例患者中只有 1 例出现了缓解,9 例患者出现了肿瘤进展。
Tivozanib 联合度伐利尤单抗用于晚期肝癌一线或 T+A 进展后二线治疗的 1b/2 期研究( #585 )
Tivozanib 是一个小分子酪氨酸激酶抑制剂,主要靶点是 VEGFR 1-3。研究一共入组了 27 例患者,安全性方面,G3 及以上 TRAE 发生率 29.6%,基本符合 TKI 的不良反应发生率。一线治疗的 21 例患者中,23.8% 出现了缓解;6 例 T+A 经治患者,未出现缓解。虽然样本量不大,但整体看来疗效比较一般。
胆管癌
IMbrave151:吉西他滨+顺铂(GC)化疗+阿替利珠单抗联合贝伐珠单抗用于胆管癌一线治疗的 2 期研究( #491 )
这是我今年最期待的一项研究。胆管癌不管发生在什么部位,但大多血供不佳。一些临床探索中显示,贝伐珠单抗这样的抗血管生成药物对部分胆管癌依然有效,但缺少随机对照研究的检验。目前,胆管癌的标准一线治疗已经成了为了 GC 化疗联合度伐利尤单抗(PD-L1 抗体)。这项随机对照的 2 期研究尝试在 GC 化疗联合 PD-L1 抗体免疫治疗(将度伐利尤单抗换成了阿替利珠单抗)的基础上增加贝伐珠单抗,看能否进一步增加疗效。
研究采用的是盲性设计,162 例患者随机接受 GC 化疗+阿替利珠单抗+贝伐珠单抗,或者接受 GC 化疗+阿替利珠单抗+安慰剂治疗。贝伐珠单抗使用的剂量跟肝细胞癌一样的大剂量,是 15 mg/kg。研究结果方面,增加了贝伐珠单抗似乎有些改善 PFS,中位 PFS 分别为 8.4 和 7.9 月(HR=0.76,95% CI: 0.51-1.14)。ORR 在两组之间没有差别,分别为 24% 和 25%。看起来增加了贝伐珠单抗后缓解持续时间有些延长,缓解超过半年的比例分别为 89% 和 47%。中位 OS 则还没有达到。
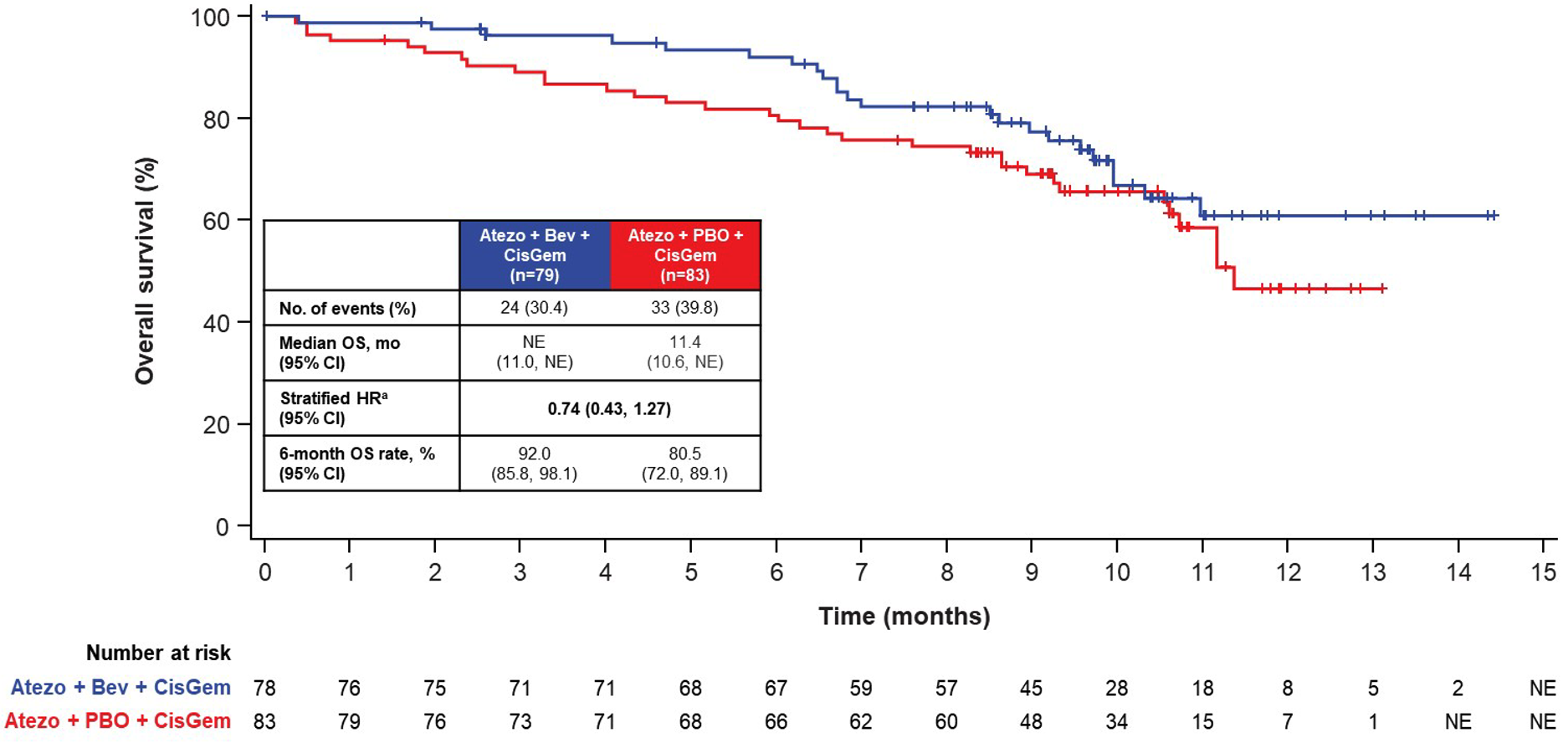
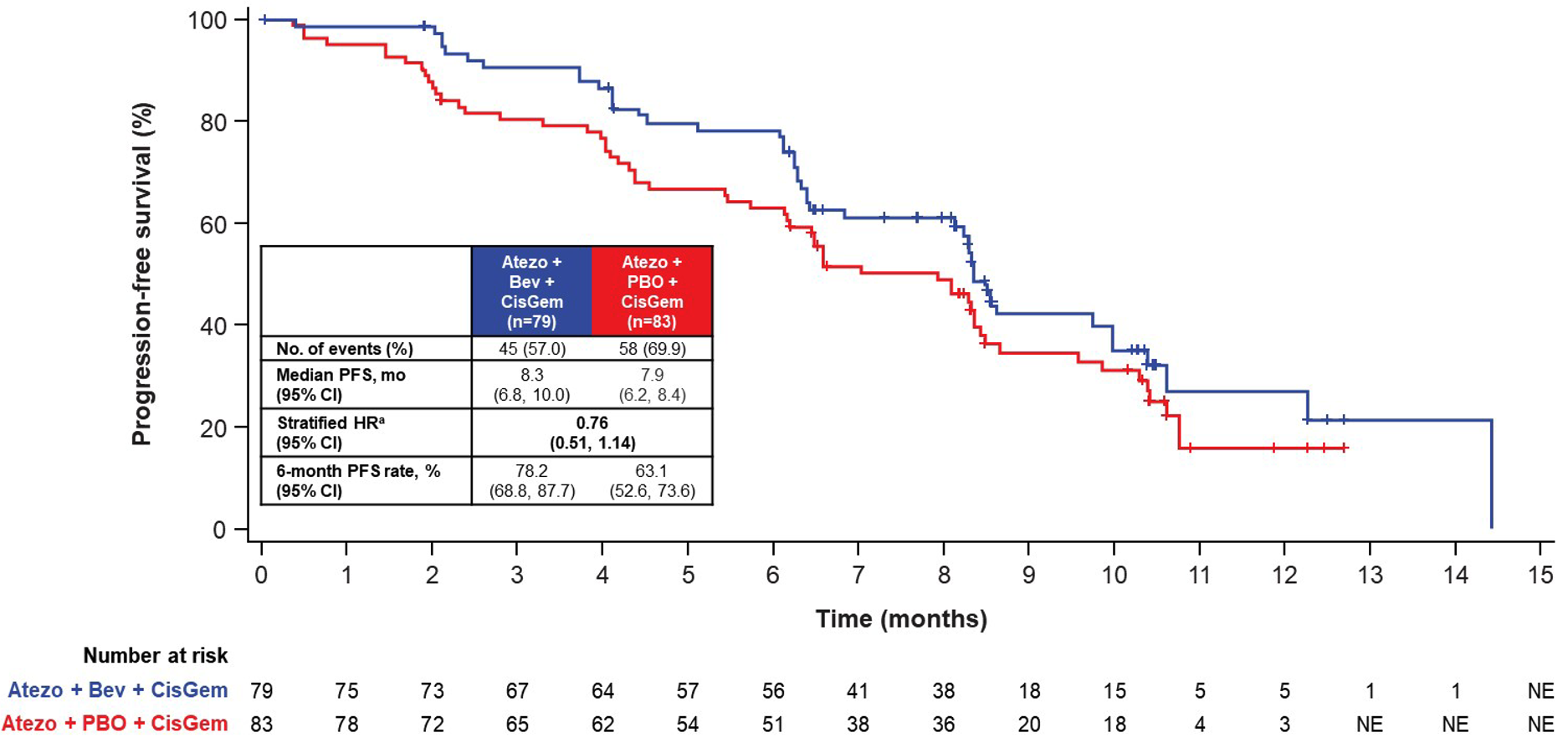
两组的不良反应相似,3-4 级不良事件的发生率分别为 73% 和 74%。不知道基于这样算是不好不坏的结果,而且贝伐珠单抗现在已经不再是一个专利药了,公司还有没有动力把这项研究往 3 期研究推进。
SWOG 1815:吉西他滨+顺铂(GC)化疗联合白蛋白紫杉醇用于胆管癌一线治疗的 3 期研究( #LBA490 )
很长时间以来 ,GC 方案化疗都是晚期胆管癌的标准治疗,尝试在这基础上增加化疗强度,例如 FOLFIRINOX 方案,都没能显著改善患者的 OS,增加 S1 口服可以部分改善患者 OS。
白蛋白紫杉醇对胆管癌而言也有一定的抗肿瘤作用,前期非随机对照的 2 期研究中显示,其与 GC 的联合,患者中位 OS 可以达到 19.2 月。基于这个良好的数据,研究者开展了这项随机对照的 3 期研究。
441 例患者按照 2:1 的比例随机接受 GC+白蛋白紫杉醇或 GC 化疗。主要终点方面,OS 未得到显著延长(14.0 vs 12.7 月,P=0.65),PFS 也没有得到显著延长(8.2 vs 6.4 月,P=0.43)。ORR 有一定的提高,从 22% 提高到了 31%,DCR 也有一定的提高,从 69% 提高到了 77%。但同时,白蛋白紫杉醇也带来了更多的 TRAE,例如贫血、白细胞减少、腹泻等等。
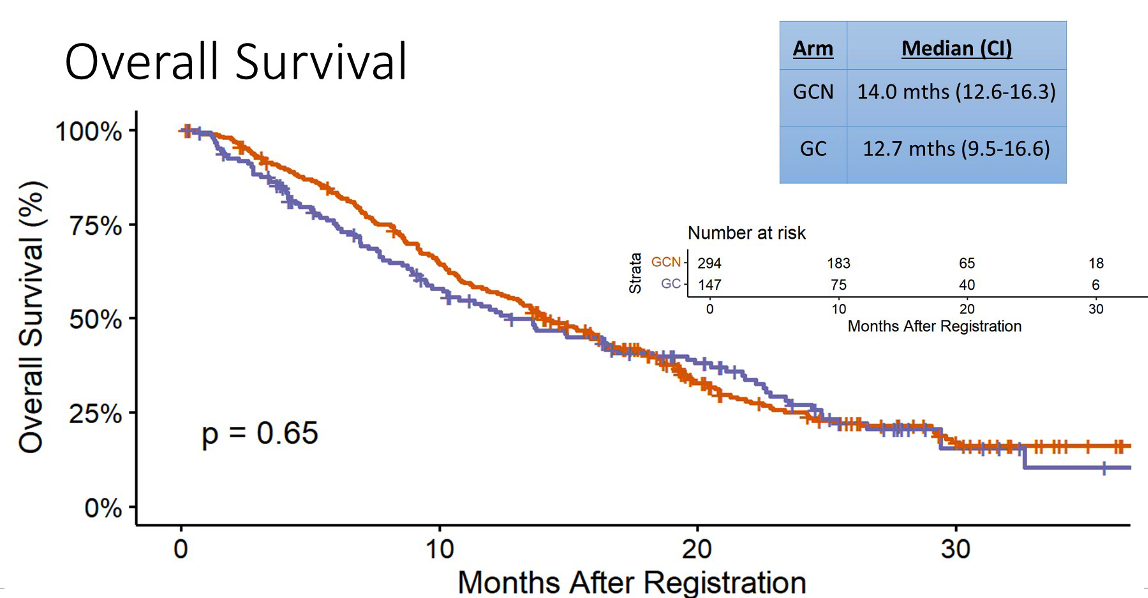
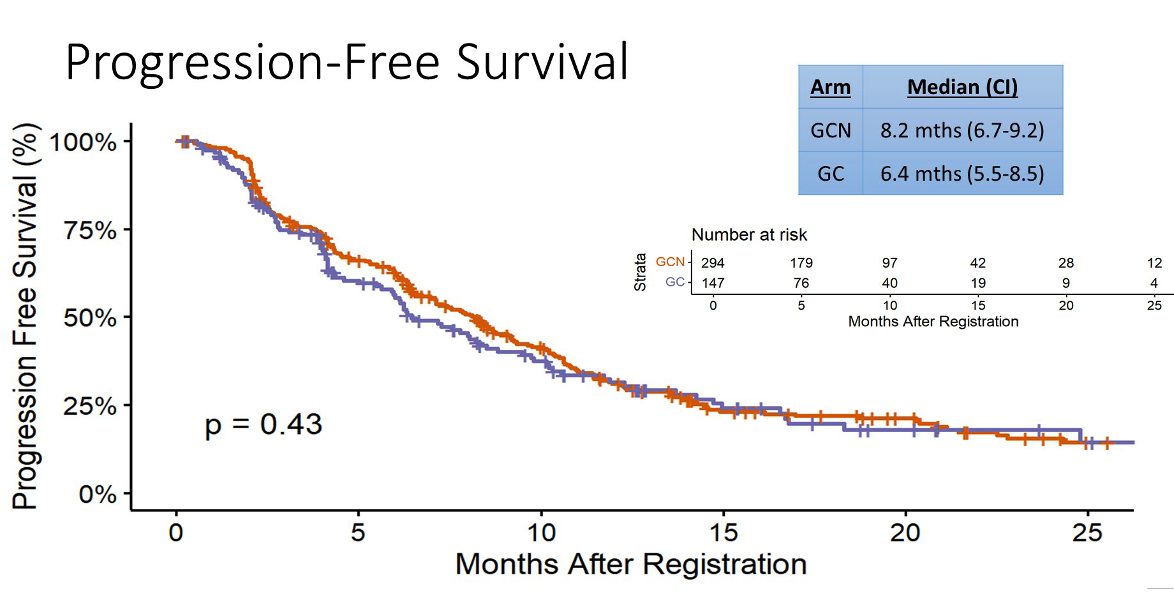
进一步的事后亚组分析中,胆囊癌患者的 OS 似乎改善比较多(17.0 vs 9.3 月),局部晚期者改善也更多(19.2 vs 13.7 月)。 目前,胆管癌已经慢慢走出了化疗时代,在 GC 方案的基础上增加度伐利尤单抗应是标准一线治疗,以后在 GC 化疗基础上增加别的化疗的探索应该不会再有了。
以下是一些新药:
BI 907828(MDM2-p53 拮抗剂)用于胆管癌治疗的 1a/1b 期研究(#543),
BI 907828 是针对 MDM2-p53 的拮抗剂,阻止两者接合,从而减少 p53 这个抑癌基因的降解。初期的疗效挺不错的,在 1a/1b 期入组的 10 例 BTC 患者中,2/6 在单药治疗组出现了 PR,3/4 在联合治疗组中出现了 PR。并且还分别有 2/6 的出现了 SD 和 1/4 出现了 SD。因为样本量太小,现在对疗效乐观还太早,但是从这很早期的数据看,这个药物值得关注。
Eradafitinib 用于 FGFR 变异的胆管癌患者二线治疗的 2 期研究(#610)
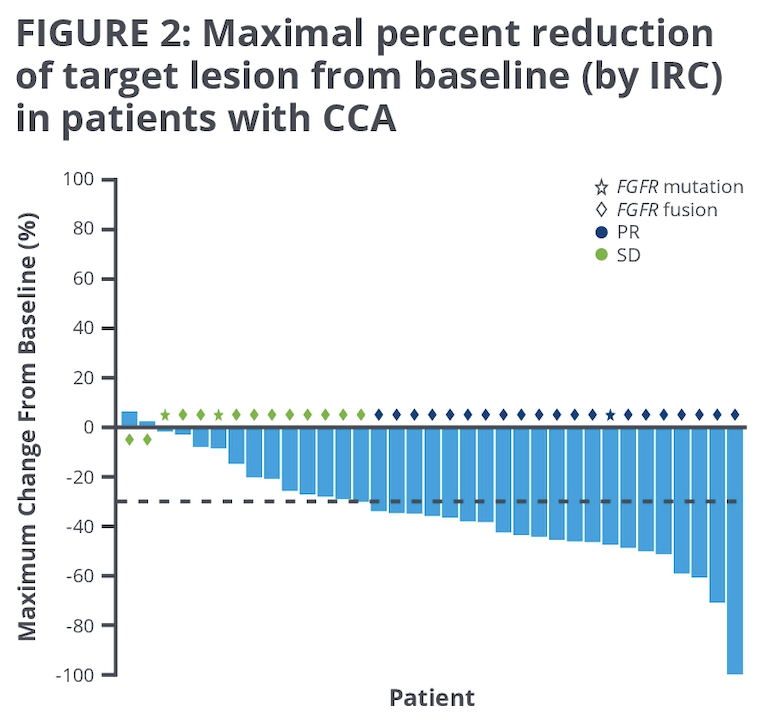
Eradafitinib 是一个广泛的 FGFR 酪氨酸激酶抑制剂,在这项 RAGNAR 的 2 期研究中,入组了特定的 FGFR1-4 融合或者突变的 BTC 患者,这些患者都经历过标准治疗,并且治疗失败。总共入组了 35 例受试者,FGFR 融合占 91.4%,突变占 8.6%;FGFR2 变异占 97.1%,FGFR3 变异占 2.9%。疗效方面非常不错,21 例(60%)出现了 ORR,DCR 达到了 100%,临床获益率(PR 或 SD 超过 4 月)达到了 71.4%。不良反应主要是高磷血症,G3 及以上的 TRAE 比较高,达到了 71.4%,80% 左右的患者因为治疗毒性需要调整剂量。
CTX-009 (ABL001)(DLL4 和 VEGF-A 的双特异性抗体)联合紫杉醇联合用于胆管癌的后线治疗的 2 期研究( #540 )
这项研究目前入组了 24 例受试者,ORR 达到 37.5%,不良反应发生率很高,治疗后 G3 及以上的不良反应发生率达到了 95.8%。
