今天,默沙东公司的帕博利珠单抗(商品名:可瑞达)和信达/礼来公司的雷莫西尤单抗(商品名:希冉择)在国内获批用于晚期肝癌的二线治疗。
帕博利珠单抗 是一个 PD-1 抗体,俗称“K药”,它的获批是基于 KEYNOTE-394 研究(晚期肝癌二线治疗:帕博利珠单抗 vs 安慰剂)。这项在亚洲地区开展的 III 期研究中,与安慰剂相比,帕博利珠单抗显著延长患者的总生存期(中位 OS:14.6 vs 13.0 月,HR=0.79,95% CI 0.63-0.99,P=0.018)。P 值低于研究预设的 0.0193,达到了主要研究终点。此外,帕博利珠单抗还进一步改善患者的 PFS(中位 PFS:2.6 vs 2.3 月,HR=0.74,95% CI 0.60-0.92,P=0.0032)、提高了客观缓解率(12.7% vs 1.3%,P<0.0001)。
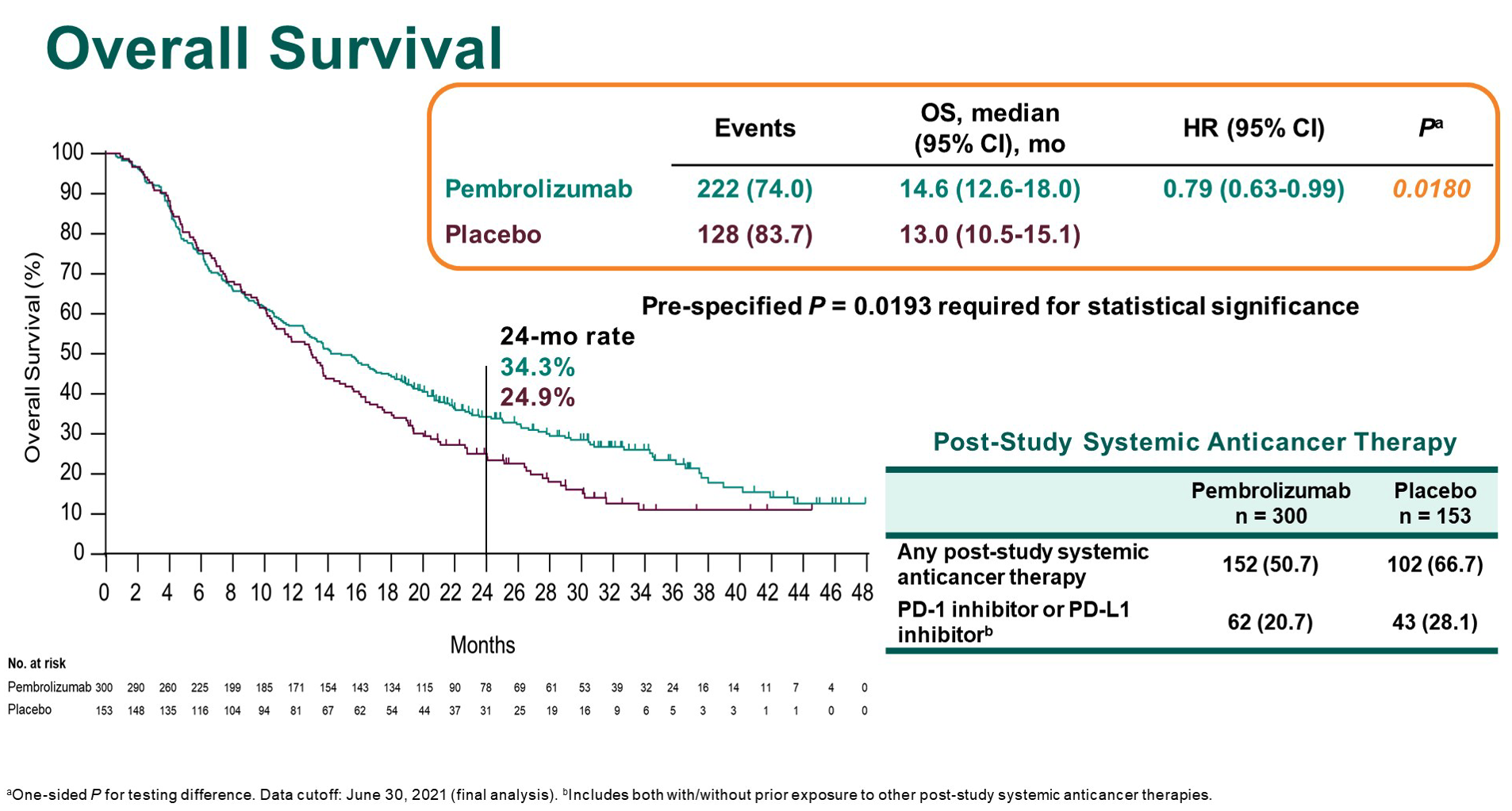
尽管已经有两个 PD-1 抗体在国内获批晚期肝癌的二线治疗适应证(恒瑞的卡瑞利珠单抗和百济神州的替雷利珠单抗),但这两个药物的获批都是基于非随机对照的 II 期研究,而帕博利珠单抗的获批是基于 [[KEYNOTE-394]] 这项安慰剂对照的 III 期研究,证据等级更高。我曾经对这项研究做过了更多的讨论,这里不再赘述。
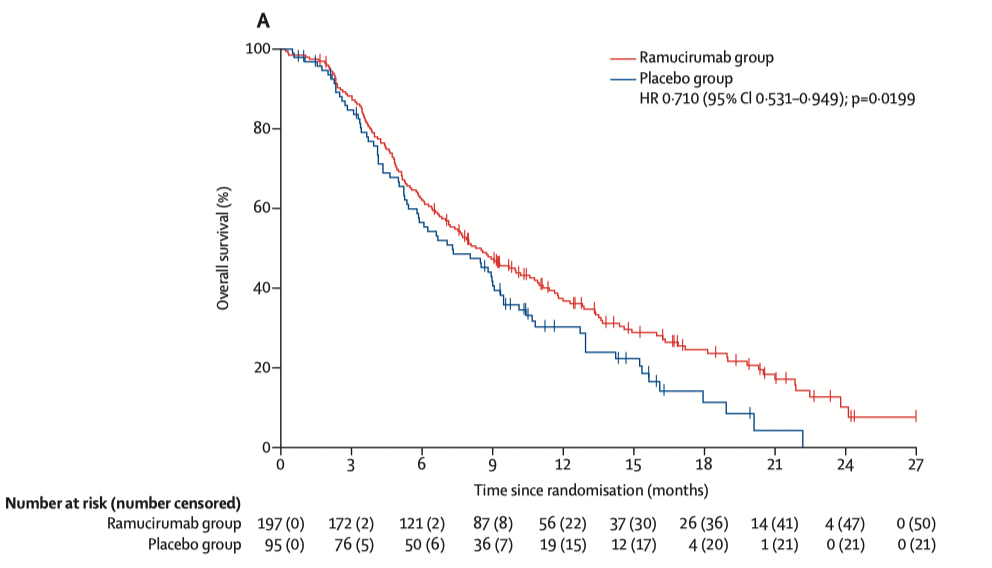
雷莫西尤单抗 以前被叫做“雷莫芦单抗”,是一个 VEGFR2 抗体,抗肿瘤血管生成是主要的作用机理(有些类似于贝伐珠单抗,后者是一个 VEGF 抗体)。它的获批是基于 REACH-2 研究(AFP ≥400 ng/mL的晚期肝癌二线治疗:雷莫西尤单抗 vs 安慰剂)和中国区的桥接试验。REACH-2 研究是一项安慰剂对照的 III 期研究,在这项研究入组的血清甲胎蛋白(AFP)≥400 ng/mL、索拉非尼治疗失败的肝癌患者。与安慰剂相比,雷莫西尤单抗(8 mg/kg iv q2w)显著改善患者的 OS(中位 OS:8.5 vs 7.3 月,HR=0.710,95% CI,0.531-0.949,P=0.0199),此也显著改善患者的 PFS(中位 PFS:2.8 vs 1.6 月,HR=0.452,95% CI,0.339-0.603,P<0.0001),两组的 ORR 分别是 5% 和 1%。作为一种单克隆抗体,雷莫西尤单抗的不良反应比较少,比较多见的不良反应是高血压和低钠血症。这个药物在 2019 年 5 月在美国获批肝癌二线治疗适应证,国内的获批晚了 3 年多。
从下表中可以看出来,雷莫西尤单抗在 OS 和 PFS 方面的获益与其他几个二线治疗药物基本相当。但作为一种大分子的抗体,雷莫西尤单抗的不良反应发生率要比小分子的激酶抑制剂低很多,其不良反应对患者的生活质量影响也会相对小很多。
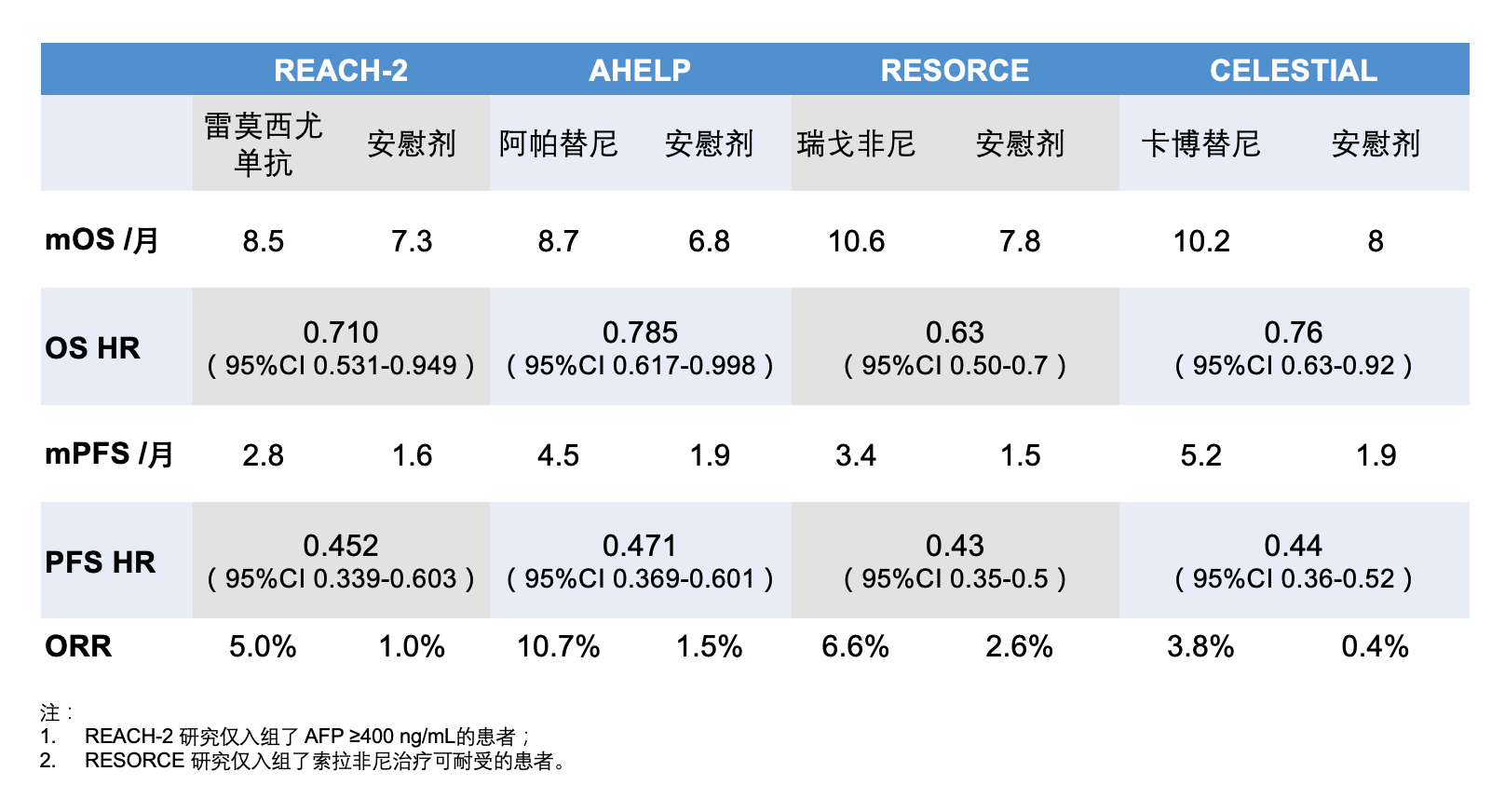
这样一来,国内有 6 个药物获批晚期肝癌二线治疗的适应证,包括 2 个小分子靶向药物(瑞戈非尼和阿帕替尼)、3 个 PD-1 抗体(帕博利珠单抗、卡瑞利珠单抗和替雷利珠单抗)和 1 个大分子的抗血管生成药物(雷莫西尤单抗)。 新的药物的获批可以给患者提供更多的选择。值得一提的是,这些二线治疗都是基于索拉非尼治疗进展或不能耐受的患者,而目前晚期肝癌的一线优选治疗以靶向联合免疫治疗为主,这些新的一线治疗失败后如何进行二线治疗,是目前非常棘手的问题。
