这是我阅读“Lessons From ADAURA on Adjuvant Cancer Drug Trials: Evidence, Ethics, and Economics”一文的读后感,也是我对肝癌术后辅助治疗的一点思考。
肝癌术后的辅助治疗是远远未被满足的临床需求。肝癌术后 5 年的复发率高达 70% 以上,但在国际上,并没有广泛认可的预防复发的措施;在国内,我们的一些单中心研究显示干扰素皮下注射和 TACE 等可以部分减少复发,延长患者生存,但都是基于单中心的研究,证据等级还得不到西方学者的认可。肝癌术后辅助治疗是我个人非常关心的领域,曾经写过一篇综述30032-5)来讨论这件事情,除了关心肝癌的研究进展,我还关心一些其他瘤种辅助治疗的临床试验,希望从那些成功的临床试验中借鉴一些经验。
去年年底,一位中学老师的爱人在肺癌手术之后需要选择辅助治疗,我咨询了肿瘤科同事,她把 ADAURA 研究的生存曲线截图给我。ADAURA 研究评估的是将奥希替尼(商品名:泰瑞沙)用于伴 EGFR 突变的肺癌术后的辅助治疗。与安慰剂相比,药物大幅度延长了患者的无复发生存期(DFS)、延长了无脑转移生存期,并且将这两个风险都下降了 80% 左右(HR 在 0.2 的水平),结果可以说是非常惊艳,也发表在新英格兰医学杂志上。文章发表时,我已经关注过,并且收录在印象笔记 “分得非常开的生存曲线” 的标签下。因为泰瑞沙比较贵,而这位老师又比较信任我,需要我帮他做判断;另外,我也比较关注术后辅助治疗临床试验的设计,所以我还是把这个研究的全文找出来看了一遍,再次对肺癌领域有这么强效的抗肿瘤药物由衷羡慕。
但是,前几天读到了发表在 JCO 杂志上的一篇评论,标题就足够抓眼球,“Lessons From ADAURA on Adjuvant Cancer Drug Trials: Evidence, Ethics, and Economics”,周末把全文精读了一遍,深感好久没读到这么好的评论文章了,值得写点东西记录一下。这篇评论借助评价 ADAURA 研究来评论了肿瘤术后辅助治疗。文章提出,我们对预防复发的治疗需要有更高的要求,需要考量这 3 个方面(3Es):
- 高级别的证据等级(Evidence);
- 伦理上过关(Ethics);
- 经济上可及(Economics)。
对于辅助治疗,DFS 不能作为 OS 的替代终点。 评论的主要批评在于,在发现泰瑞沙可以推迟/减少肿瘤复发之后,独立的数据委员会就提早结束了研究,没有充分延长观察时间,以评估药物是不是可以延长 OS,因为延长 DFS 未必就延长 OS。在化疗时代,因为病人复发之后,没有像样的复发后治疗的手段(那时候系统治疗的效果非常有限),所以复发之后等待病人的就是肿瘤进展后死亡。但是当前有了很好的后线治疗手段,DFS 很可能跟 OS 并不相关,所以提早结束了研究非常不明智。而且有这样的前车之鉴,一往的 EGFR 抑制剂在 DFS 方面 HR 也低至 0.35 的水平,但的并没能转化成 OS 的获益。 如果存在一个抗肿瘤活性很强的靶向治疗,某患者在术后没有接受该治疗,出现了较早的肿瘤复发,这时候再接受这种抗肿瘤活性很强的靶向治疗(把最强效的药物节省到了复发之后再使用),预期可以生存获益,所以复发后的生存时间会较长;而另一个患者在手术之后接受了这个药物用于复发,他的确获益,肿瘤复发时间较长,但这个肿瘤一旦复发,复发的肿瘤细胞对这个药物是耐药的,从而在复发后的治疗就失去了这个强效的药物,复发后的生存预计会比较短。患者手术后的 OS = DFS + 复发后生存,这样相互抵消之后,患者手术后的 OS 可能会不存在差异。简单来说,就是等病人复发了再来使用最好的治疗可能也不迟。
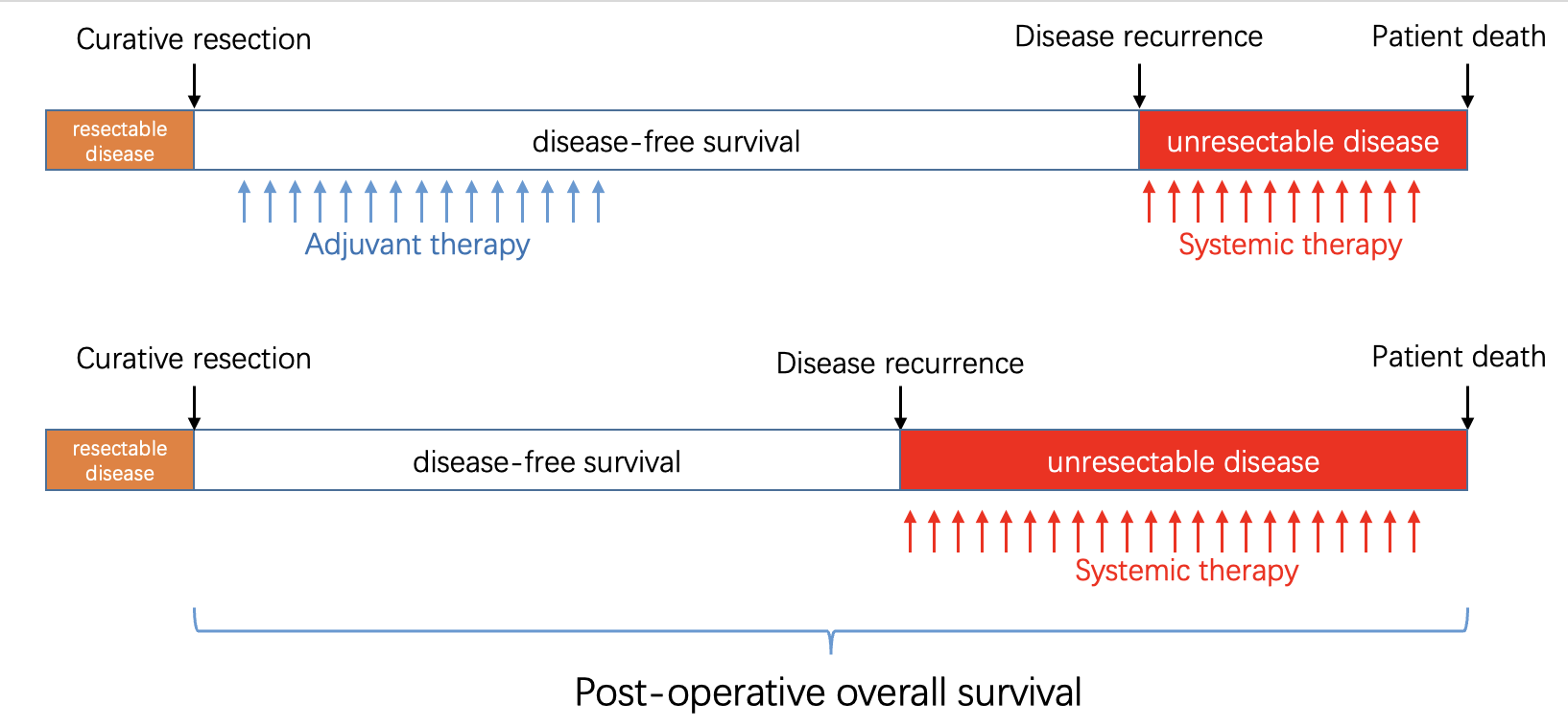
相比较针对晚期肿瘤的治疗,辅助治疗应有更高的要求。 晚期肿瘤的病人可能会存在肿瘤相关的症状,这时候给予治疗,肿瘤稳定或缩小,会给病人带来生活质量的改善。而接受了手术切除的病人,一般不存在肿瘤相关的症状,这时给病人药物治疗,只能带来副作用,从而降低病人的生活质量。并且,在辅助治疗时,因为病人体内没有肿瘤,在肿瘤复发之前,也就没办法知道病人已经被手术切掉的肿瘤是不是对这个治疗敏感。一种治疗的疗效再好,也会存在先天对该治疗不敏感的原发耐药的肿瘤。可能病人闷着头吃了一两年的靶向药,承受着治疗引起的生活质量下降和经济损失,但其实并没有带来什么好处。与之相反,晚期肿瘤的病人,因为处于带瘤状态,可以根据肿瘤大小和肿瘤指标的变化,可以尽早判断某项治疗是不是有效,从而可以避免病人更长时间暴露于该无效的治疗。因此,对于预计需要术后辅助治疗的患者(高危复发的患者),都应该在切除之前就开始尝试这种计划中的辅助治疗,通过影像学和手术标本的病理检查评估治疗的敏感性(算是个体化评估药物疗效),只有术前评价了有效的治疗才应该在手术之后使用,这才能帮助消灭残余的播散肿瘤细胞。否则,无差别的使用辅助治疗,可能会使部分患者白白暴露于药物的副作用,但残余的肿瘤细胞又没有被药物杀伤到。另外,即使对于治疗有效的病人,治疗的压力也可能让残余的播散肿瘤细胞出现了继发性耐药。而播散肿瘤细胞并不会造成肿瘤相关症状,就将肿瘤细胞暴露于这么好的药物,造成了继发性耐药显得更加可惜。
其他问题。 另外,研究执行上可能存在一些缺陷,例如在手术前没有使用足够敏感的影像学方法(例如 PET/CT 或头颅 MRI)来排除脑转移的可能(suboptimal staging),所以得出来的预防脑转移发生的结论可能只是治疗了未被充分诊断的脑转移。另外,EGFR 突变的病人的标准治疗是术后固定疗程的 4 个周期的化疗(已经被证明生存获益),而这个研究不强制要求病人接受这样的化疗,这违反了伦理,因为病人如果分配到了安慰剂组,并且放弃了化疗,则放弃了生存获益。更符合伦理的做法是应该使用泰瑞沙跟化疗相对比,或者在化疗的基础上增加泰瑞沙。
没想到,这么漂亮的研究也会遭到这么多批评,这让我对 critical thinking 的认识提高了一个层次。上一次读到的这么有料的评论文章还是 Bruix 教授对国内的一项肝癌研究的批评00205-0/fulltext)。5年以前,我觉得这些批评过于苛刻,但随着我对肿瘤研究领域的逐渐了解,慢慢觉得 Bruix 教授的每一条批评都是对的。肝癌领域还有很长的道路要走。例如,尽管高级别的随机对照研究已经显示,对于接受了根治性治疗的肝癌病人,索拉非尼既不推迟 DFS,也不延长 OS,但不少病人在手术之后还是在使用索拉非尼,而索拉非尼的治疗毒性比这个评论里的泰瑞沙要大得多。所以,肝癌领域辅助治疗的一些做法在证据和伦理上还差得更远。