不夸张地讲,最近几年,国内肝癌的临床实践或多或少地受到了这个临床试验的影响。尽管这是一个最终样本量也只有 100 例的 1b 期临床试验,但是却向我们传递出了很多希望,让我们开始对晚期肝癌的药物治疗有了一些想象。
这是一项全球多中心的单臂临床试验,了解在不可切除肝癌患者一线使用仑伐替尼+帕博利珠单抗(可瑞达/K 药)(俗称“可乐组合”)联合治疗的疗效和安全性,被称为是 KEYNOTE-524 (Study 116) 研究。这个研究也一直选择在各大肿瘤学的国际会议上公布研究进度,今年的 ASCO 年会上也公布了最终的结果,现在论文全文发表出来了,值得深入阅读一遍。
整体而言,可乐组合显示出了强大的抗肿瘤活性,随着样本量的进一步扩大,疗效数据也基本保持稳定。研究分为两个阶段,我们主要看评估疗效的扩展阶段。这个阶段一共募集了 100 例未经系统治疗的不可手术的肝癌患者。患者接受仑伐替尼口服(根据体重,8 mg/d 或 12 mg/d)+ 帕博利珠单抗 200 mg q3w 静滴。
主要终点方面,独立影像评估的 ORR 分别为 46%(mRECIST 标准)和 36%(RECIST v1.1 标准)。并且,药物起效非常快,中位至缓解时间为 1.9 月和 2.8 月。从靶病灶直径变化的瀑布图上来看,绝大部分患者在治疗初期都出现了肿瘤负荷下降。下图是独立影像基于 RECSIT v1.1 标准评估的肿瘤负荷变化,有 83% 的患者出现了靶病灶不同程度的缩小。
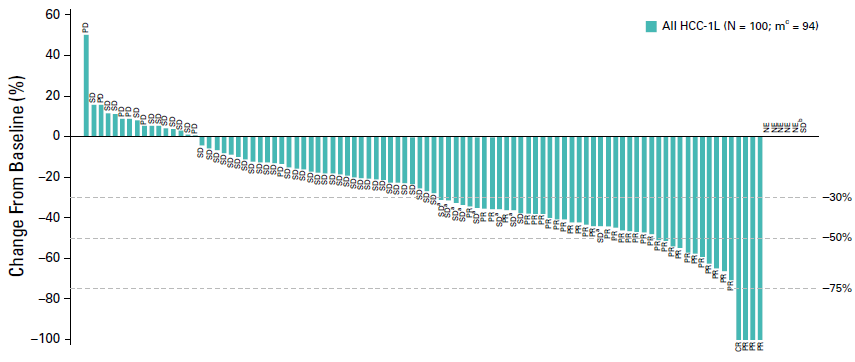
此外,中位缓解时间(DOR)分别为 8.6 月和 12.6 月,这个疗效算是比较持久的。此外,对应两种评估标准的中位 PFS 分别为 9.3 月和 8.6 月。中位 OS 则长达 22 月(单臂研究姑且看看)。
安全性方面,这个方案的治疗不良事件相对较多,3 级及以上治疗相关不良事件的发生率为 67%,其中 3% 的死亡考虑跟药物相关。
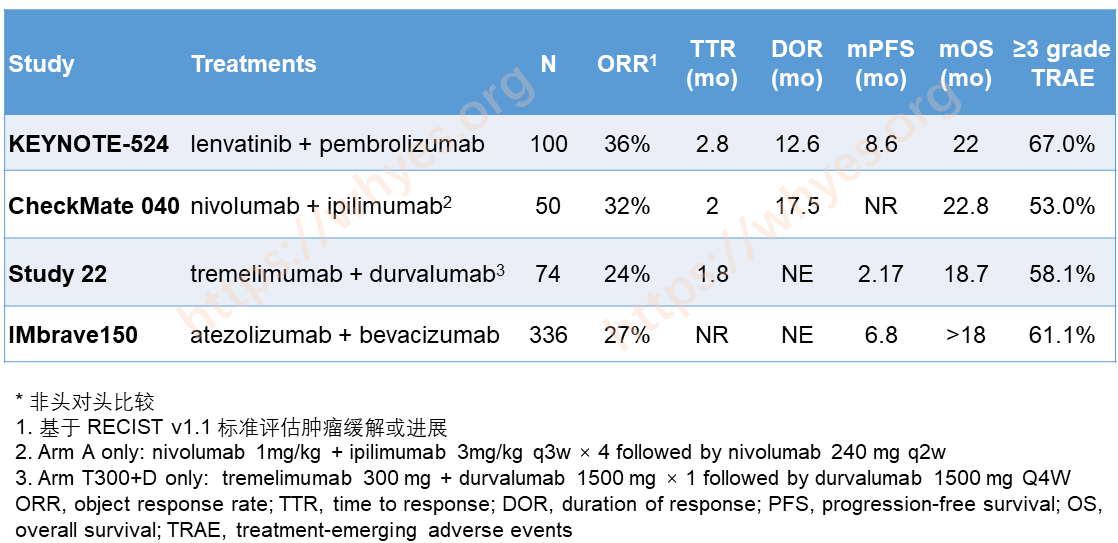
下表比较了研究得比较多的几种联合治疗方案的疗效和安全性数据。整体而言,可乐组合的 ORR 最高。
因为帕博利珠单抗目前在国内没有肝癌的适应证,没有慈善政策的帮助,使用的费用非常昂贵,大多数患者都承担不起。临床实践上,我们也经手了一些仑伐替尼联合 PD-1 抗体(包括帕博利珠单抗或其他国产的 PD-1 抗体)治疗的不可切除肝癌患者。这些患者的疗效数据跟这个临床试验基本相当。在 43 例接受该方案作为一线治疗的患者中,研究者评估的 ORR 为 60.5% 和 41.9%(对应 mRECIST 和 RECIST v1.1 标准)(Sun, et al. ASCO 2020)。
这项研究中,高达 83% 的患者接受可乐组合治疗后肿瘤负荷下降,而只有 17% 的患者肿瘤继续生长。在现阶段,这个方案应该是不可切除肝癌的最佳转化治疗方案,因为既可以让大多数患者肿瘤缩小,又可以保证尽可能少的患者肿瘤继续生长。
基于这个单臂研究,卫材和默沙东公司曾经寻求在美国上市,申请将这个方案用于晚期肝癌的一线治疗,然而被 FDA 拒绝了。主要的理由是,目前罗氏的阿替利珠单抗 + 贝伐珠单抗的联合治疗已经在美国获批用于一线治疗,临床上晚期肝癌一线治疗的稀缺性已经被部分解决,所以就没有批准该方案了,这也算是情理之中的事情。这个方案与仑伐替尼单药头对头对比的 3 期临床试验(LEAP-002)已经完成了患者入组,预计明年初会公布研究结果。尽管联合治疗的结果喜人,但在 OS 上能不能优于抗肿瘤活性本身就很强的仑伐替尼单药,我不太确定。但不管最后的结果怎么样,这个方案引发了我们很多联想,以至于让我们可以提起将药物治疗用于不可切除肝癌的转化治疗,而在两三年前,我们连想都不敢想。