胆道系统肿瘤(BTC)是一组肿瘤的统称,包括胆管癌(肝内胆管癌、肝门胆管癌和远端胆管癌)和胆囊癌。不同部位的 BTC 都是来源于胆道上皮细胞的癌变,生物学特征相似,抗肿瘤治疗方案也相似。如前文的讨论【链接】,不可切除或晚期 BTC 的治疗很困难,目前标准的一线治疗是化疗联合免疫治疗,但疗效不尽人意。大约有 10% 的 BTC 有 HER2 高表达,其中胆囊癌阳性率较高,肝内胆管癌阳性率较低。尽管阳性的人群比例不算高,但这部分可能会获益于抗 HER2 治疗。早期已经有了一些小型探索,包括使用曲妥珠单抗联合帕妥珠单抗的 MyPathway 研究【链接】、曲妥珠单抗联合化疗 KCSG-HB19-14 研究00335-1/abstract)、抗 HER2-ADC 药物的 DESTINY-PanTumor02研究 等等,都提示抗HER2治疗表现出了一定的临床疗效。但因为样本量较小或者没有在国内开展研究,此前还没有同类药物在国内获批 BTC 治疗的适应证。
2025 年 5 月 29 日,泽尼达妥单抗(zanidatamab,曾用名:ZW25,商品名:百赫安)被通过附条件批准用于既往接受过全身治疗的 HER2 高表达(免疫组化染色 3+)的不可切除、局部晚期或转移性 BTC。这项批准基于的是HORIZON-BTC-01 研究,这是一项全球多中心的单臂的 IIb 期研究,评估的是该药物用于既往至少接受过含吉西他滨治疗的 HER2 阳性 BTC 后线治疗的疗效和安全性。我们中心的樊嘉教授和 MSKCC 的 James J Harding 教授共同牵头完成了这项研究。此前,该研究的主要结果已经 发表在 Lancet Oncology 杂志上00242-5/abstract)。
泽尼达妥单抗是一种抗 HER2 的双特异性抗体,通过两个不同的抗原结合域靶向 HER2,包括 HER2 二聚化结构域和细胞外近膜结构域,从而达到更强效的抗 HER2 作用。前期的 I 期临床试验00621-0/abstract)入组了22 例 BTC 患者,客观缓解率(ORR)38%,显示出了不错的抗肿瘤作用。
关键研究结果
HORIZON-BTC-01 研究入组的是经过了原位杂交确认 HER2 扩增(包括免疫组化 3+ 和 2+)的不可切除或晚期 BTC 患者。这些患者至少接受过吉西他滨为基础的化疗但出现了疾病进展。泽尼达妥单抗的使用方式是 20mg/kg,静脉滴注,每 2 周一次。研究总共入组了 80 例 HER2 阳性患者,其中免疫组化染色 2+占 23%、3+占 78%,胆囊癌、肝内胆管癌和肝外胆管癌分别占 51%、29% 和 20%。 在中位随访 12.4 月后,主要终点方面,中心影像评估的 ORR 为 41.3%;有效的患者,起效非常迅速,中位至缓解时间 1.8 月;中位缓解持续时间(DOR)12.9 月。疾病控制率 68.8%,中位 PFS 5.5 月。
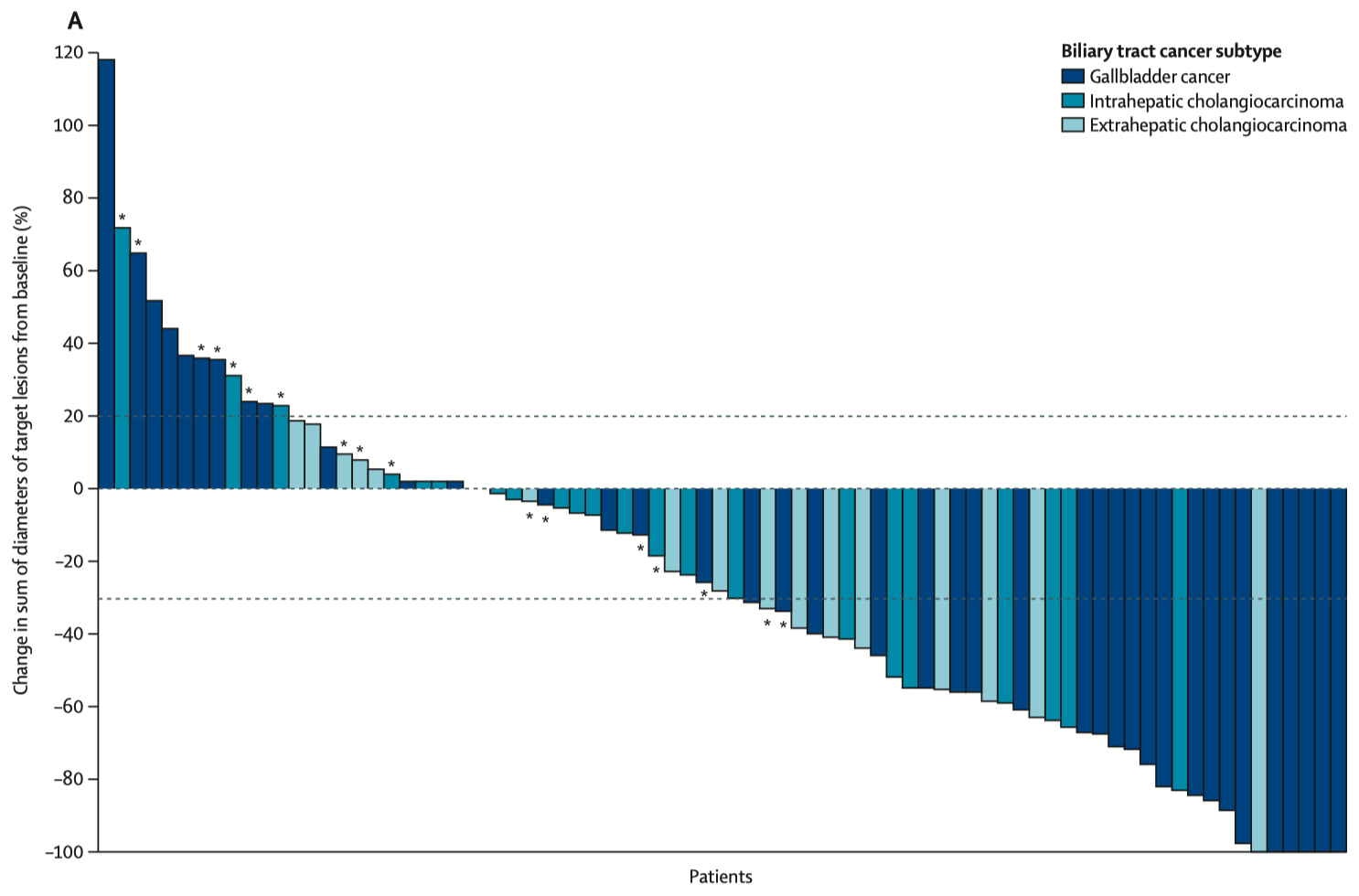
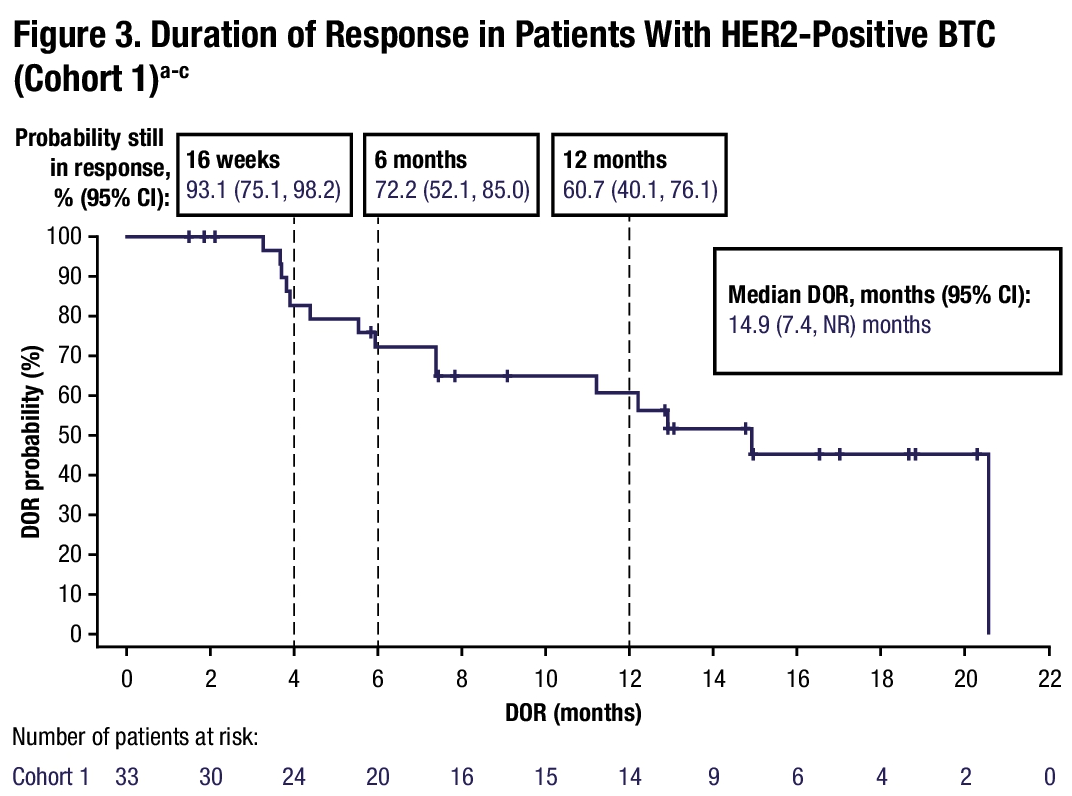
在 2024 年的 ASCO 会议上,该研究公布了进一步的随访结果(Pant S, Fan J, et al. ASCO 2024 abs 4091),中位 DOR 达到了 14.9 月。
中位生存期(OS)则达到了 15.5 月(95% CI 10.4-18.5 月)。患者的生存时间与 HER2 表达相关,免疫组化 3+和 2+的患者的中位 OS 分别为 18.1 和 5.2 月。
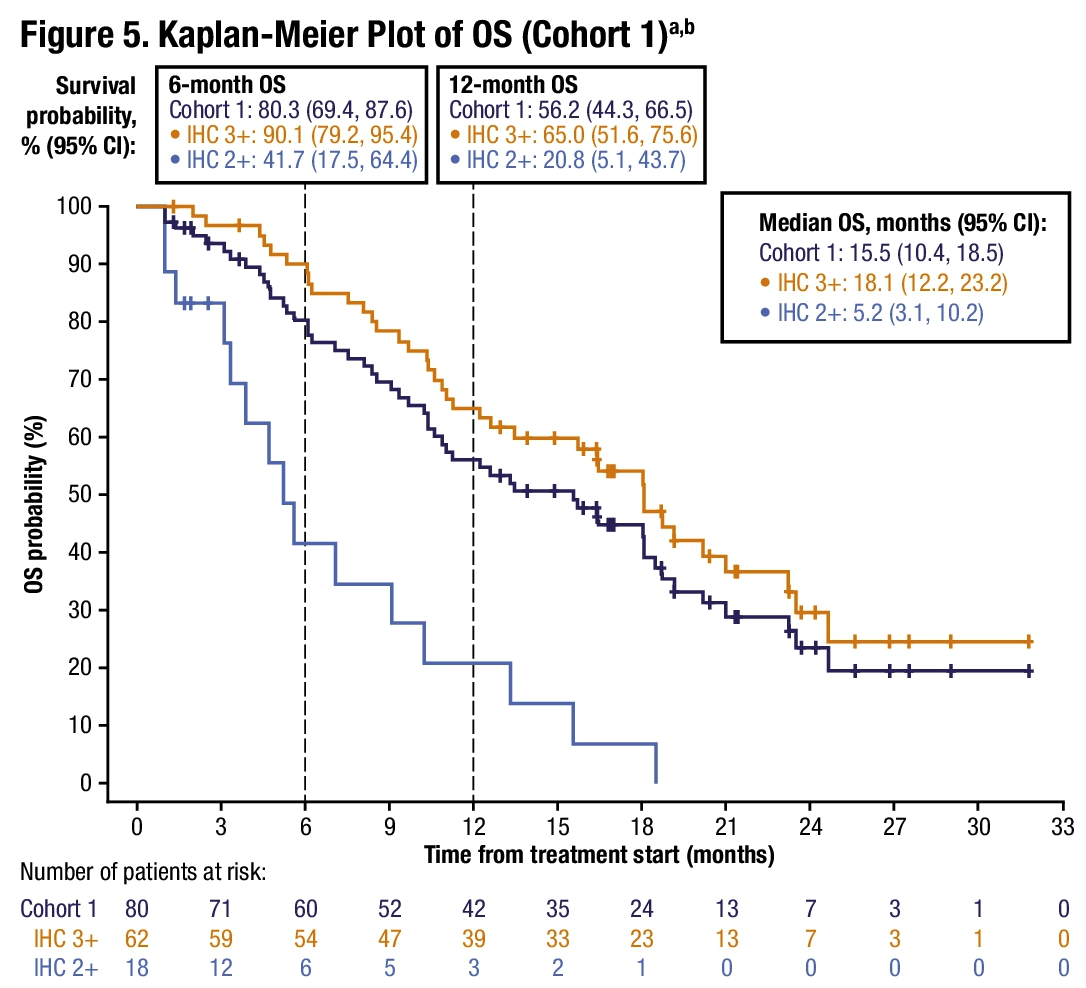
对于后线的 BTC 患者,ORR 能达到 40% 以上,中位 OS 可以超过 1 年,算是非常亮眼的数据了。这些疗效数据在同类药物中都做到目前的最好水平。
药物治疗的耐受性很好,3 级治疗相关不良事件(TRAE)发生率只有 18%,最常见不良事件包括腹泻、输液反应和心脏射血分数下降。没有发生 4-5 级的 TRAE。
总结
目前,该泽尼达妥单抗正在开展确证性的 III 期研究(HERIZON-BTC-302),评估其与 GC 化疗和免疫治疗联合作为不可切除 BTC 的一线治疗的可行性,对照组则是目前的标准治疗(GC 化疗联合免疫治疗)。以往没有接受过抗肿瘤治疗的 HER2 阳性患者可以到我们门诊接受筛选,参与该研究。 我曾经讨论过,虽然指南推荐对不可切除 BTC 患者进行肿瘤基因检测,但因为阳性率很低,药物可及性也不好,所以大多数情况下基因检测的帮助并不大。但 HER2 检测做免疫组化就可以完成,不需要支付昂贵的基因检测费用,便利性不错。目前,国内已经有了获批治疗 FGFR2 融合/重排的佩米替尼【链接】;治疗 IDH-1 突变的艾伏尼布【链接】(国内获批适应证,但可以买到);现在又多了一个针对 HER2 高表达的泽尼达妥单抗。随着时间推移,BTC 的精准治疗的版图慢慢开始显露了出来。
病例报告
这里分享我们中心入组了一例受试者。患者中年男性,肝穿刺活检确诊为晚期肝内胆管癌。一线接受了 GEMOX 化疗联合 PD-1 单抗和仑伐替尼治疗后,出现了肿瘤进展和梗阻性黄疸,接受了经皮肝穿刺胆管引流(PTCD)治疗。因为肿瘤组织 HER2 免疫组化染色 3+,在接受充分的减黄治疗后,孙惠川教授推荐他参加了这项临床试验。
这个患者在治疗后很快出现了肿瘤缩小,影像评估为部分缓解。最难能可贵的是,肿瘤缩小后对胆道的压迫减轻,他成功拔除了 PTCD 引流管,生活质量得到了明显的改善。在治疗 1 年多后,治疗出现耐药,肿瘤进展。但当时全身其他部位影像学找不到转移灶,他后来还接受了手术切除。
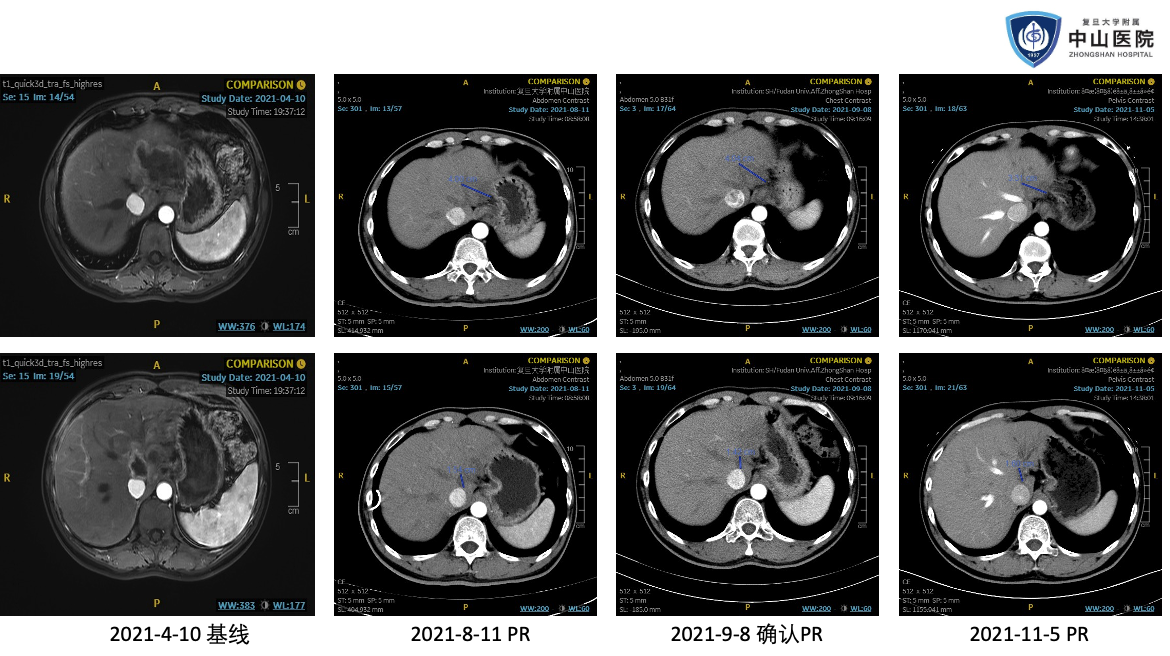
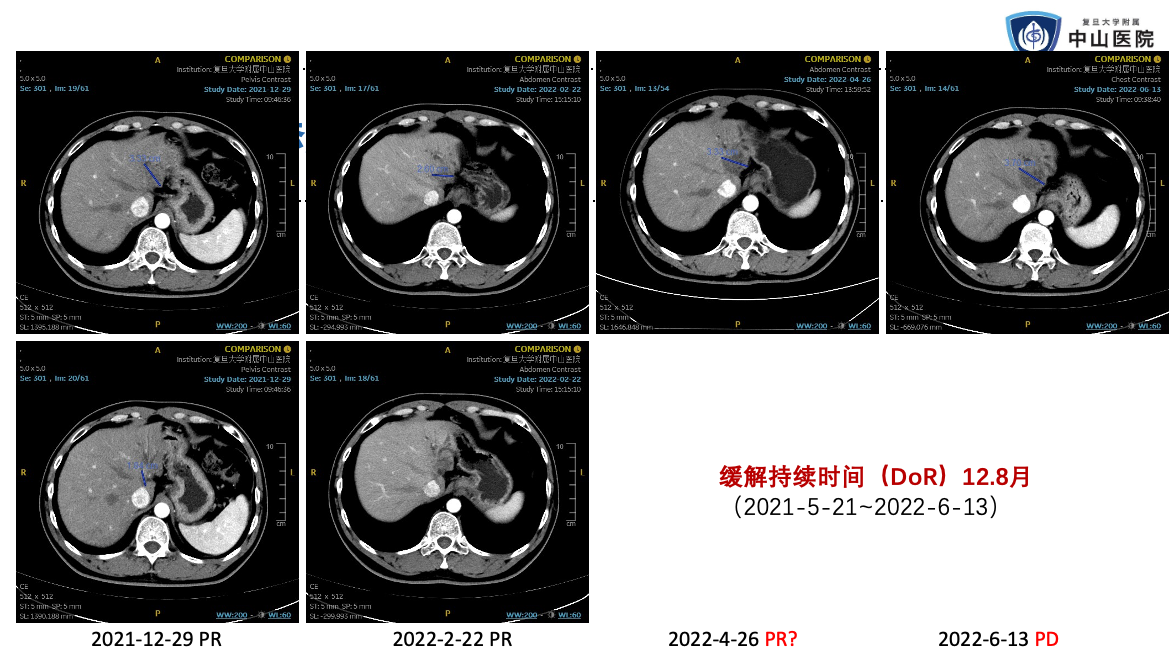
这个患者的不良反应也比较轻微,主要不良反应是输液反应和腹泻。
写在最后:参与了一项新药临床试验,这项试验让一个新药获批上市,是挺值得高兴的一件事。这里衷心感谢入组患者和家属的付出和信任。
