最近几年,肝细胞癌(HCC)系统治疗取得了巨大进步,这也推动了肝癌指南的更新。近期, 欧洲肿瘤内科学会(ESMO)也更新了肝癌诊疗指南,全称是《Hepatocellular carcinoma: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up》(ESMO 肝细胞癌诊断、治疗和随访临床实践指南)。 虽然我们的临床实践与欧洲并不完全相同,但不少观点值得借鉴。这里将该指南的推荐意见做了罗列,并将一些重要观点使用 粗体字 标注,另外增加了一些个人评论。

发病率和流行病学
- 考虑到肝癌发病与慢性肝病相关,推荐婴儿在出生时普遍接种乙肝疫苗 [II, A]。乙肝病毒 (HBV) 和丙肝病毒 (HCV) 感染者应尽早抗病毒治疗 [III, A]。
- 所有伴有活动性 HBV 感染的肝癌患者均推荐抗病毒治疗 [II, A]。
- 对合并活动性 HCV 感染的肝癌患者,通常推荐接受直接抗病毒药的治疗,但时机应个体化 [IV, B]。
前阵子,一些回顾性研究提示,在肝癌根治术后马上开始抗 HCV 治疗,可能会增加肝癌的复发率,但该观点存在很多争议。
筛查
- 如果肝功能和合并症允许抗肿瘤治疗,建议对所有肝硬化患者进行 HCC 监测,无论其病因如何 [II, A]。
言下之意,如果肝功能失代偿了,即使诊断了肝癌也无法抗肿瘤治疗。对于这样的患者,肝癌筛查的意义不太大。但个人觉得,这部分病人如果诊断了肝癌,可以增加肝移植优先性,因此还是有必要进行定期肝癌筛查的。
- 建议对 HCC 风险评分(例如 PAGE-B 评分系统)中、高风险的乙肝患者在开始抗病毒治疗时,进行 HCC 监测 [II, A]。
- HCC 监测应包括每半年一次肝脏超声检查(如果可行,也可以 CT 或磁共振检查),联合或不联合甲胎蛋白(AFP)检查 [II, A]。
- 液体活检和循环肿瘤 DNA 分析目前不推荐用于 HCC 监测 [IV, D]。
诊断、病理学和分子生物学
诊断
- HCC 的诊断应包括病史、体检、实验室、影像学和组织学检查 [III, A]。
- HCC 的诊断应基于组织学检查和/或增强影像检查(包括增强 CT、增强 MRI 和超声造影) [III, A]。
- 对于 HCC 高风险患者,通过 CT 或 MRI 进行诊断时,可以结合肿瘤大小、非边缘动脉期强化、外周廓清、包膜强化和肿瘤外形等影像学特征 [IV, B]。
- 对于 HCC 高风险患者,通过超声造影(CEUS)进行诊断时,可以结合非边缘动脉期强化和延迟(>60 秒)且轻度廓清等影像学特征 [IV, B]。
病理学
- 对于没有肝硬化、低风险或没有已知 HCC 风险因素的患者,建议进行组织病理学确认(通过从肝脏或转移灶获取组织活检)进行诊断 [IV, A]。
- 晚期 HCC 患者开始系统治疗前建议进行组织病理学诊断 [III, A]。
这是非常重要的改变。
- 对于肝细胞-肝内胆管混合型肝癌,应进行基因检测 [IV, A]。
这点跟肝内胆管癌的推荐保持一致了。
- 为促进生物标志物研究,建议对参加临床试验的所有患者进行肿瘤活检 [IV, A].
同上,这也是非常重要的改变。事实上,已经有不少临床试验做这样的要求了。但可惜的是,穿刺活检仍然不能充分排除混合型肝癌或者碰撞癌的可能。
- 除了罕见的家族性 HCC 病例或在遗传咨询后怀疑有遗传性肝病的情况 [IV, B],不常规推荐在诊断时进行系统的种系遗传检测 [IV, D]。
- 不推荐液体活检和 ctDNA 分析用于 HCC 的常规临床诊断 [IV, D]。
分期和风险评估
- 建议进行 HCC 分期以优化治疗方案,应包括肿瘤范围、肝功能、门脉高压、AFP 和 PS 评分 [III, A]。
- 不推荐 FDG-PET 作为常规分期方式 [III, D],但在某些情况下可能适合进一步评估 CT 或 MRI 上的发现 [IV, C]。
近期,一项来自于法国的前瞻性研究进一步证实了这个观点。增加 PET/CT 检查可以改变部分肝癌病人的肿瘤分期,但只有2%的病人的治疗方案在增加 PET/CT 检查后会发生改变,因此可以认为,PET/CT 检查用于肝细胞癌的分期价值比较有限。
- 应通过 Child-Pugh 和/或 ALBI 评分系统评估肝功能 [III, A]。MELD-Na 应用于确定接受肝移植排队时的优先级 [IV, A]。
- 应根据 Baveno VII 标准,通过间接测量或通过经颈静脉途径以侵入性方式评估门静脉高压 [III, A]。
- 推荐使用 BCLC 分期系统来预测患者预后和确定治疗方案 [IV, A]。
下图是使用 BCLC 分期系统来决定治疗策略:
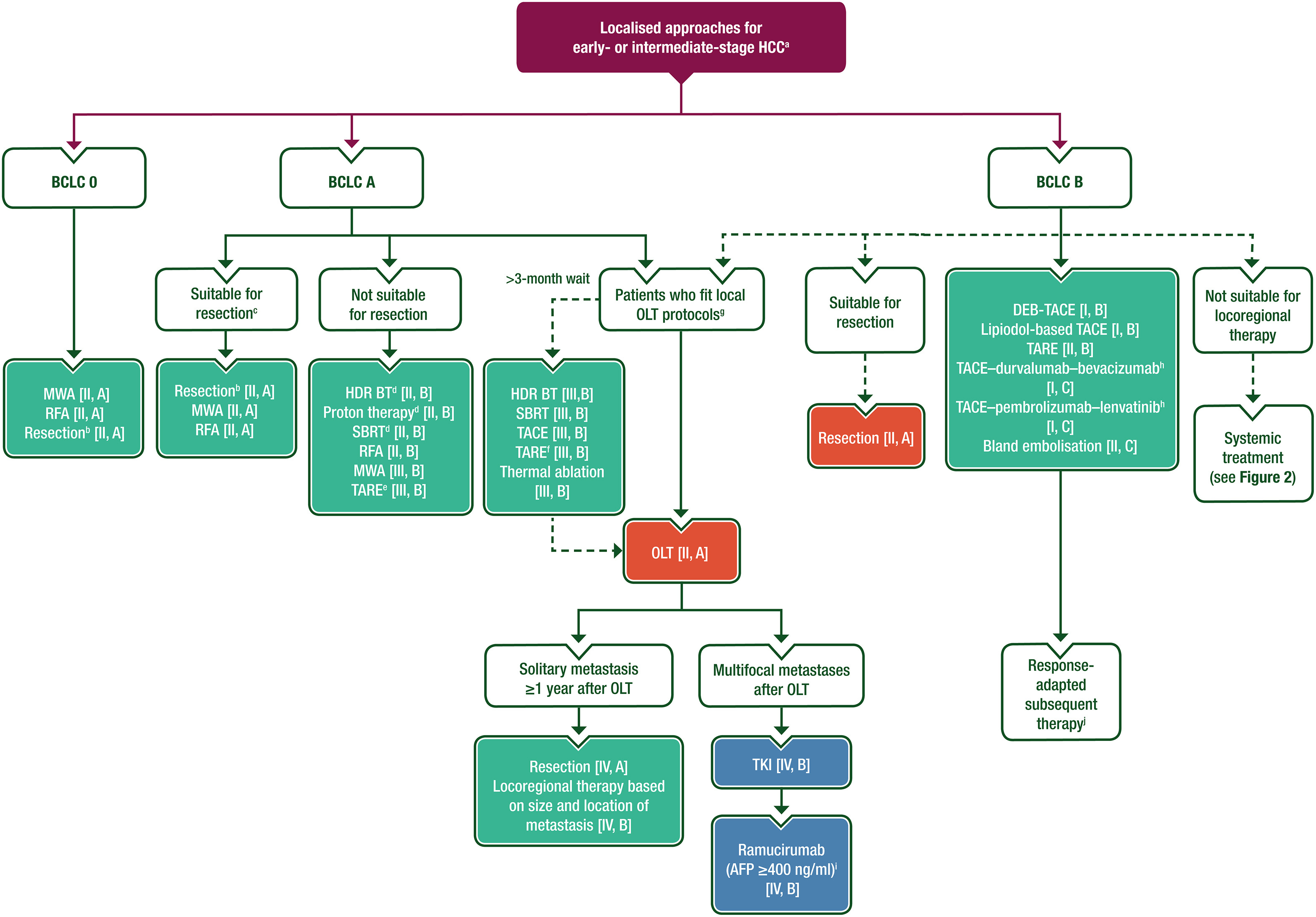
早期(BCLC 0 和 A 期)和中期(B 期)肝癌的治疗
- 强烈建议对早期和中期肝癌患者进行多学科团队 (MDT) 管理 [II, A]。
肝切除
- 对于单个肿瘤 >2 厘米且无门静脉高压的患者(BCLC 0-A 期),建议进行肝切除 [II, A]。
- 建议对 Child-Pugh A 级肝功能且无明显门静脉高压或其他禁忌症的患者进行肝切除 [III, A]
- 对于稳定的 Child-Pugh B 级肝功能和/或轻度门静脉高压的患者,可以考虑进行肝切除,但要仔细评估肝功能失代偿的风险 [III, B]。
- 对于不适合介入治疗的中期肝癌(BCLC B 期) ,手术切除可以作为可选择的治疗[II, A]。
- 对于合并肝硬化的肝癌患者,手术建议采用微创切除术 [III, A]。
- 对于极早期肝癌(BCLC 0)(单发肿瘤,直径不超过2 cm) ,推荐使用微波消融(MWA)或射频消融(RFA) [II, A]。
- 对于早期肝癌(BCLC A)中,MWA 或 RFA 可以作为手术切除的替代方案 [II, A]。
- 切除或消融的选择应考虑技术限制,并应由 MDT 讨论 [III, A]。
- 对于不适合手术切除或作为肝移植( OLT)桥接治疗,可推荐使用 MWA 或 RFA 治疗直径 3-5 厘米的孤立性肿瘤或多灶性疾病(≤3 枚肿瘤,且直径≤3 厘米)(BCLC A 期)[II, B]。
辅助治疗
- 不建议在手术切除或消融后使用靶向治疗或基于免疫治疗的联合治疗作为术后辅助治疗 [I, E]。
随着 IMbrave050 研究进一步随访后 RFS 获益无法维持,药物治疗作为肝癌术后辅助治疗,又回到了无药可推荐的状态。
- 肝移植后不建议进行辅助治疗 [IV, E]。
肝移植
- 当预计复发率 <10% 且 5 年生存率达到 70% 时,建议对符合米兰标准的患者进行肝移植 [II, A]。
- 对于超出米兰标准的肝癌患者,也可以考虑使用 UCSF 标准来选择肝移植的受者 [III, B]。
- 在预期 5 年生存率 >50% 的患者中,肝移植的推荐度优于局部治疗 [II, B]。
- 当预计肝移植等待时间较长(>3 个月)时,可以为患者提供局部高剂量近距离放射治疗、立体定向放疗(SBRT)、肝动脉化疗栓塞(TACE)、肝动脉放疗栓塞(TARE)或热消融作为肝移植的桥接治疗 [III, B]。在等待肝移植的小肿瘤患者,TARE 的推荐度高于 TACE [II, A]。
- 对于接受了全身治疗(包括免疫治疗)且肿瘤情况符合移植条件的患者,可考虑肝移植,尽管末次用药的时间离肝移植越近,急性排斥反应的风险越大 [IV, C]。
- 不建议肝癌肝移植的患者常规转换为 mTOR 抑制剂 [I, D]。
- 肝移植术后 1 年以上发生的孤立性转移的患者,建议进行手术切除 [IV, A]。也可以根据转移灶的大小和位置推荐局部治疗 [IV, B]。
- 肝移植后发生多灶性复发或转移的患者,可以推荐小分子靶向药物(TKI)作为一线全身治疗 [IV, B]**.
- 对于 AFP ≥400 ng/ml 的患者,可以考虑在 TKI 后使用雷莫西尤单抗 [IV, B; 仅欧洲药品管理局 (EMA) 和食品和美国药监局 (FDA) 批准索拉非尼一线治疗后使用]。
放疗
- 在早期 HCC 中,对于不适合消融或在消融后复发的肿瘤(BCLC A 期),可以考虑使用 SBRT、质子治疗和高剂量近距离放疗作为热消融的替代方案 [II, B]。
血管内治疗
- 对于单发的直径 ≤8 厘米的肿瘤,如果不适合手术切除,选择性或节段性 TARE 可以作为一种替代选择(BCLC A 期)[III, B]。
- 对于中期 HCC(BCLC B 期),推荐使用药物洗脱微球(DEB)-TACE 或传统的碘油 TACE,DEB-TACE 可以最大限度地减少化疗的全身副作用 [I, B]。
- 在中期肝细胞癌 (BCLC B 期) 中,TARE [II, B] 或单纯栓塞 [II, C] 可被视为 TACE 的替代治疗。
- 在中期肝细胞癌 (BCLC B 期) 患者中,可考虑使用 TACE 联合度伐利尤单抗和贝伐珠单抗或 TACE 联合帕博利珠单抗和仑伐替尼的联合治疗,但这些联合治疗的长期获益尚不确定 [I, C;未经 EMA 或 FDA 批准]。
还是要等待 LEAP-012 和 EMERALD-1 研究长期随访后看 OS 的获益情况,才能最终确定中期肝癌是否需要在 TACE 的基础上增加系统治疗。
- 不推荐 TACE 与 TKI 联用 [I, E]。
- 如果在第二次 TACE 治疗后未达到实质性的肿瘤坏死,应停止 TACE 治疗 [III, A]。
- 在临床试验之外,不能推荐基于未知预测价值的预后评分算法来选择患者进行首次或重复 TACE [III, D]。
没有接受 up-to-7 或 6-and-12 等标准来分层预测 TACE 治疗疗效,有些意外。
- 应使用改良的 RECIST (mRECIST) 标准来评估中期肝癌局部治疗的疗效 [III, A]。
下图是不可切除/晚期肝癌的系统治疗策略:
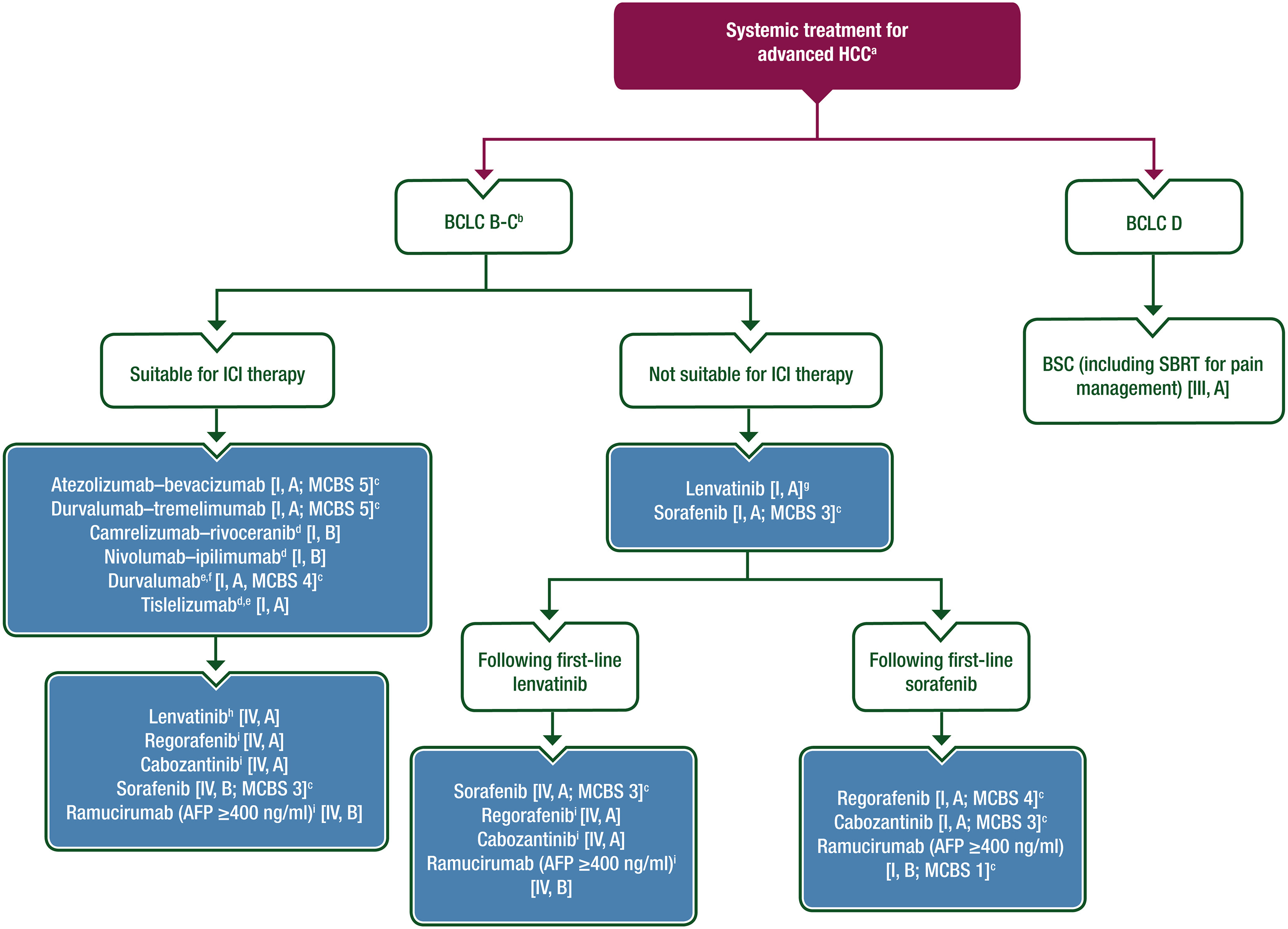
晚期肝癌的治疗
一线系统治疗
- 对于肝功能良好且 ECOG PS 0-1 分的患者(BCLC B-C 期):
- 建议使用阿替利珠单抗联合贝伐珠单抗(T+A 方案) [I, A;ESMO 临床获益量表 (ESMO-MCBS) v1.1 评分:5] 或度伐利尤单抗联合曲美木单抗(STRIDE 方案) [I, A;ESMO-MCBS v1.1 评分:5]。
- 对于门静脉高压的患者,强烈建议在开始使用 T+A 方案之前进行静脉曲张筛查 [IV, A]。
- 可以推荐卡瑞利珠单抗联合阿帕替尼(双艾组合) [I, B;未经 EMA 或 FDA 批准] 或纳武利尤单抗联合伊匹木单抗(O+Y 方案) [I, B;未经 EMA 或 FDA 批准]。
- 对免疫联合疗法有禁忌的患者,应考虑使用度伐利尤单抗 [I, A;ESMO-MCBS v1.1 评分:4;EMA 批准,未获 FDA 批准] 或 替雷利珠单抗 [I, A;未经 EMA 或 FDA 批准]单药治疗。
- 对免疫治疗有禁忌症的患者,建议使用仑伐替尼 [I, A;通过 ESMO-MCBS v1.1 确定了与索拉非尼的非劣效性] 或索拉非尼 [I, A;ESMO-MCBS v1.1 评分:3]。
国内药厂开发双艾组合和替雷利珠单抗开展了全球多中心的临床试验,终于获得了欧洲指南的认可。
- 对于肝功能不佳和/或 ECOG PS ≥2 分的患者(BCLC D 期),建议采取最佳支持治疗,包括 SBRT 治疗疼痛 [III, A]。
二线系统治疗
- 接受了至少一种系统疗法后进展且肝功能良好且 ECOG PS 0-1 分的患者:
- 应考虑使用瑞戈非尼 [I, A;ESMO-MCBS v1.1 评分:4;EMA 和 FDA 批准用于一线索拉非尼治疗后] 或卡博替尼 [I, A;ESMO-MCBS v1.1 评分:3;EMA 和 FDA 批准用于一线索拉非尼治疗后]。
- 对于 AFP ≥400 ng/ml 的患者,可以考虑使用雷莫西尤单抗 [I, B;ESMO-MCBS v1.1 评分:1;EMA 和 FDA 批准用于一线索拉非尼治疗后]。
- 在一线仑伐替尼治疗后,应考虑使用索拉非尼 [IV, A;ESMO-MCBS v1.1 评分:3]。
- 在一线免疫治疗后,应考虑 使用仑伐替尼 [IV, A;未经 EMA 或 FDA 批准用于二线使用]。
- 在一线免疫治疗后,可考虑 使用索拉非尼 [IV, B;ESMO-MCBS v1.1 评分:3]。
化疗
- 全身化疗尚未在随机试验中显示出对生存的改善,因此不建议使用 [II, D]。
治疗顺序
- 建议在免疫联合治疗或仑伐替尼后按顺序使用已获批上市的药物 [III, A]。
放疗
- 外放射治疗(EBRT)可应用于治疗骨转移引起的疼痛 [III, A] 或因 HCC 负荷高引起的肝脏疼痛 [II, A]。
临床试验的终点选择
- 主要病理缓解(MPR)应作为新辅助治疗的 II 期研究的主要终点,OS 作为次要终点 [V, A]。
- 无复发生存期(RFS)应作为新辅助治疗的 III 期研究的主要终点,MPR 和 OS 作为次要终点 [V, A]。
- RFS 应作为辅助治疗的随机对照试验(RCT)的主要终点,OS 作为次要终点 [V, A]。
- OS 应作为中期肝癌 RCT 的主要终点 [V, A]。OS 和无进展生存期(PFS)的共同主要终点也可以推荐,尽管不那么强烈 [V, B]。
- OS 应作为晚期肝癌 RCT 的主要终点,PFS 作为次要终点 [V, A],不推荐作为共同主要终点 [V, D]。
疗效的评估和随访
- 存活的肿瘤应使用 CT 或 MRI 进行评估,并应定义为动脉期对比剂的摄取 [III, A]。
- mRECIST 可推荐用于评估局部治疗后的缓解或进展 [III, B]。
- 在日常临床实践中,可以推荐使用 mRECIST 标准来评估病灶活性,以帮助治疗决策 [III, B]。
- 对于接受过根治性治疗(手术或热消融)的患者,无论是否接受过辅助治疗,随访应包括对肝脏失代偿的临床评估,并通过增强 CT 或增强磁共振来及早发现复发。在手术后的 2 年内,每 3 个月进行一次复查;5 年之内,每半年进行一次复查 [III, A]。
- 对于接受过局部治疗和/或全身药物治疗的晚期 HCC 患者,随访应包括对肝脏失代偿的临床评估,并通过增强 CT 或增强磁共振每 3-4 个月进行一次肿瘤评估,以指导治疗决策 [III, A]。
